Molybdänsäure hat die Verhältnisformel H2MoO4 und kann als Monohydrat des Molybdäntrioxids aufgefasst werden: MoO3 · H2O. Im Gegensatz etwa zur scheinbar analog aufgebauten Schwefelsäure (H2SO4), existieren keine diskreten H2MoO4-Moleküle, stattdessen besteht Molybdänsäure aus einem Schichtengitter aus MoO6-Oktaedern (gelbe, monokline Form) bzw. Zickzackketten von MoO6-Oktaedern (farblose, trikline Form).[2] Die konjugierte Base der Molybdänsäure MoO42− heißt Molybdat, die Salze der Molybdänsäure heißen Molybdate wie Nickelmolybdat. Die Molybdationen bestehen, analog den Sulfationen, aus MoO42−-Tetraedern.[2]
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
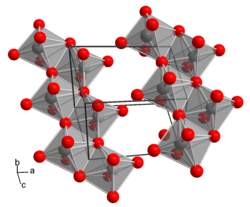
| ||||||||||||||||
| _ Mo6+ _ O2− Kristallstruktur von H2MoO4 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Molybdänsäure | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | MoO3 · H2O | |||||||||||||||
| Kurzbeschreibung |
farbloser (triklin) bzw. gelber (monoklin) Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 161,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
0,5 g·l−1 (Monohydrat, 15 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Molybdat (MoO42−) stellt die bioverfügbare, d. h. für Lebewesen nutzbare Form von Molybdän dar.[5]
Man kann Molybdänsäure als weißen Niederschlag erhalten, wenn man eine Molybdatlösung ansäuert. Salpetersaure Molybdatlösungen können bei längerem Stehen auch das gelbe Hydrat der Molybdänsäure H2MoO4 · H2O in kristalliner Form abscheiden.[6]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu MOLYBDIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 20. November 2021.
- ↑ a b c d e A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- ↑ a b c Datenblatt Molybdänsäure etwa 85 % MoO3, enthält Ammoniummolybdat bei Merck, abgerufen am 11. April 2011.
- ↑ D'Ans-Lax: Taschenbuch für Chemiker und Physiker, 4. Auflage, Band 3, Springer Verlag 1998, ISBN 3-540-60035-3.
- ↑ Schwarz G. et al.: Molybdenum cofactors, enzymes and pathways. In: Nature. 460. Jahrgang, Nr. 7257, 2009, S. 839–847, PMID 19675644.
- ↑ Jander/Blasius, Lehrbuch der analytischen und präparativen anorganischen Chemie, 8. Auflage, S. Hirzel Verlag, Stuttgart 1969.

