Cannabinoide

Cannabinoide sind Transformationsprodukte und synthetische Analoga einiger Terpenphenole, die hauptsächlich in der Hanfpflanze (Cannabis sativa bzw. Cannabis indica) gefunden wurden. Die Erforschung von Cannabinoiden führte zur Entdeckung des Endocannabinoid-Systems. Körpereigene Substanzen, die ähnliche pharmakologische Eigenschaften haben, werden Endocannabinoide genannt. Neuere Forschung zeigt, dass auch andere Pflanzen Phytocannabinoide produzieren, die genauso wie die Cannabinoide der Hanfpflanze am Endocannabinoid-System wirken.[1][2][3]
Medizinisch werden Cannabinoide in verschiedenen Anwendungsgebieten eingesetzt, etwa bei neuropathischen Schmerzen und Spastiken (Zubereitungen aus Cannabisblüten), bei Appetitlosigkeit bei HIV/AIDS sowie Übelkeit und Erbrechen unter einer Chemotherapie (Nabilon, Dronabinol), sowie bei bestimmten kindlichen Epilepsieformen (Cannabidiol).
Phytocannabinoide
Phytocannabinoide der Hanfpflanze

Die Hanfpflanze C. sativa enthält mindestens 113 Phytocannabinoide aus der Gruppe der Terpenphenole, die bisher in keiner anderen Pflanze entdeckt wurden.[4] Das am meisten untersuchte Cannabinoid ist Δ9-Tetrahydrocannabinol (Δ9-THC), das 1964 von Yehiel Gaoni und Raphael Mechoulam am Weizmann-Institut für Wissenschaften in Israel isoliert wurde.[5] Cannabinoid-Säuren als Vorläufer neutraler Cannabinoide waren in den 1950er-Jahren wegen ihrer antibiotischen Wirkung bekannt und wurden z. B. in der Tschechoslowakei in der Tiermedizin eingesetzt. Cannabidiol (CBD), ein weiteres wenig psychoaktives Cannabinoid, wird wegen seiner entzündungshemmenden, anti-schizophrenischen und anti-epileptischen Eigenschaften untersucht. Die meisten anderen Cannabinoide wurden auf Psychoaktivität untersucht.[6]
Einige Phytocannabinoide der Cannabispflanze:[7]
| Cannabinoid-Typ | Anzahl | Cannabinoid-Typ | Anzahl | Cannabinoid-Typ | Anzahl | Cannabinoid-Typ | Anzahl |
|---|---|---|---|---|---|---|---|
| Δ9-Tetrahydrocannabinol | 9 | Δ8-Tetrahydrocannabinol | 2 | Δ9-Tetrahydrocannabivarin | - | Cannabidiol | 7 |
| Cannabigerol | 6 | Cannabichromen | 5 | Cannabicyclol | 3 | Cannabielsoin | 5 |
| Cannabitriol | 9 | Cannabinol[8] | >1 | Cannabinodiol[8] | >1 | Verschiedene | 11 |
Cannabis enthält auch eine Vielzahl von Nicht-Cannabinoiden, über 120 verschiedene Terpene und 21 Flavonoide mit verschiedenen pharmakologischen Eigenschaften. Es gibt Hinweise, dass Cannabinoide wie Cannabinol (CBN), Cannabidiol (CBD) und andere die Wirkung von Δ9-THC modifizieren.
Die im Cannabis enthaltenen Cannabinoide haben teilweise entgegengesetzte Wirkungen: Einige Cannabinoide sind u. a. Agonisten der Rezeptoren CB1/CB2, andere äußern hingegen entweder keine Affinität oder sind Antagonisten.
Welche Anteile der Cannabinoide in Cannabis vorhanden sind, variiert stark in Abhängigkeit von Faktoren wie Sorte/Genetik, Lagerbedingungen oder geographischer Herkunft.
Phytocannabinoide der Hanfpflanze als tabellarische Übersicht
| Phytocannabinoide der Hanfpflanze[9] | ||||
|---|---|---|---|---|
| Cannabigerol-artige (CBG) | ||||

Cannabigerol |

Cannabigerol Monomethylether |

Cannabinerolsäure A |

Cannabigerovarin |
|

Cannabigerolsäure A |

Cannabigerolsäure A Monomethylether |

Cannabigerovarinsäure A |
||
| Cannabichromen-artige (CBC) | ||||

(±)-Cannabichromen |

(±)-Cannabichromensäure A |

(±)-Cannabivarichromen, (±)-Cannabichromevarin |

(±)-Cannabichromevarinsäure A |
|
| Cannabidiol-artige (CBD) | ||||

(−)-Cannabidiol |

Cannabidiol Monomethylether |

Cannabidiol-C4 |
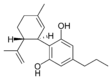
(−)-Cannabidivarin |

Cannabidiorcol |

Cannabidiolsäure |

Cannabidivarinsäure |
|||
| Cannabinodiol-artige (CBND) | ||||

Cannabinodiol |

Cannabinodivarin |
|||
| Tetrahydrocannabinol-artige (THC) | ||||

Δ9-Tetrahydrocannabinol |

Δ9-Tetrahydrocannabinol-C4 |

Δ9-Tetrahydrocannabivarin |

Δ9-Tetrahydrocannabiorcol | |

Δ9-Tetrahydro- |
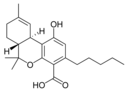
Δ9-Tetrahydro- |

Δ9-Tetrahydro- |

Δ9-Tetrahydro- |

Δ9-Tetrahydro- |

(−)-Δ8-trans-(6aR,10aR)- |

(−)-Δ8-trans-(6aR,10aR)- |

(−)-(6aS,10aR)-Δ9- |
||
| Cannabinol-artige (CBN) | ||||

Cannabinol |

Cannabinol-C4 |

Cannabivarin |

Cannabinol-C2 |

Cannabiorcol |

Cannabinolsäure A |

Cannabinolmethylether |
|||
| Cannabitriol-artige (CBT) | ||||

(−)-(9R,10R)-trans- |

(+)-(9S,10S)-Cannabitriol |

(±)-(9R,10S/9S,10R)- |

(−)-(9R,10R)-trans- |

(±)-(9R,10R/9S,10S)- |

8,9-Dihydroxy-Δ6a(10a)- |
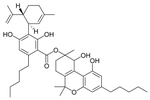
Cannabidiolsäure A |

(−)-(6aR,9S,10S,10aR)- |

(−)-6a,7,10a-Trihydroxy- |

10-Oxo-Δ6a(10a)- |
| Cannabielsoin-artige (CBE) | ||||

(5aS,6S,9R,9aR)- |

(5aS,6S,9R,9aR)- |
|||

(5aS,6S,9R,9aR)- |

(5aS,6S,9R,9aR)- |

(5aS,6S,9R,9aR)- |
||

Cannabiglendol-C3 |

Dehydrocannabifuran |

Cannabifuran |
||
| Isocannabinoide | ||||
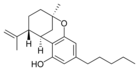
(−)-Δ7-trans-(1R,3R,6R)- |

(±)-Δ7-1,2-cis- |

(−)-Δ7-trans-(1R,3R,6R)- |
||
| Cannabicyclol-artige (CBL) | ||||

(±)-(1aS,3aR,8bR,8cR)- |

(±)-(1aS,3aR,8bR,8cR)- |

(±)-(1aS,3aR,8bR,8cR)- |
||
| Cannabicitran-artige (CBT) | ||||

Cannabicitran |
||||
| Cannabichromanon-artige (CBCN) | ||||

Cannabichromanon |

Cannabichromanon-C3 |

Cannabicoumaronon |
||
Phytocannabinoide anderer Pflanzen
Forscher an der Eidgenössischen Technischen Hochschule in Zürich haben 2006 gezeigt, dass N-Isobutylamide aus Echinacea eine neue Klasse von potenten Cannabinoidmimetika darstellen, die an die peripheren CB2-Cannabinoid-Rezeptoren auf Immunzellen binden, aber nicht an die CB1-Rezeptoren im zentralen Nervensystem.[1] Somit ist Cannabis sativa nicht die einzige Pflanze, die Cannabinoid-Rezeptor-Liganden herstellt. Beta-Caryophyllen kommt in diversen Gewürzpflanzen vor und ist auch ein CB2-Cannabinoid.[10] Yangonin aus der Kavapflanze (Piper methysticum) und diverse Catechine aus der Teepflanze (Camellia sinensis) wirken ebenfalls als CB1-Rezeptoragonisten.[3][2]
Endocannabinoide
Anandamid, 2-Arachidonylglycerol, O-Arachidonylethanolamid, N-Arachidonoyldopamin, γ-Linolenoylethanolamid, Docosatetraenoylethanolamid und 2-Arachidonylglycerylether sind körpereigene Cannabinoide (Endocannabinoide), die als Neurotransmitter am Endocannabinoid-System wirken.[11][12]
Synthetische Cannabinoide

Künstliche Cannabinoide können sowohl halbsynthetisch hergestellt werden, d. h. aus natürlichen Cannabinoiden, als auch vollsynthetisch aus einfachen Grundstoffen. Synthetische Cannabinoide werden medizinisch genutzt und dienen in der Neurowissenschaft dazu, die Cannabinoidwirkung im Gehirn zu verstehen. Anwendung finden sie auch in Kräutermischungen als legaler Cannabisersatz.[13] Einige synthetische Cannabinoide sind z. B.[14]
| CP-55,940: 1974 synthetisiert, 40–50x so potent wie Δ9-THC | CP-47,497: (in der Modedroge "Spice" als Hauptwirkstoff nachgewiesen)[15] | HU-210: 100–800-fache Potenz bezogen auf THC, soll nach Tierversuchen eine zellwachstumsfördernde und antidepressive Wirkung haben | HU-211: ist das Enantiomer von HU-210 |
| HU-308 | HU-331 | RCS-4 | RCS-8 |
| SR-141716A: Ist ein selektiver CB1-Antagonist und war kurzzeitig für die Gewichtsreduktion als Arzneimittel zugelassen. Es wird außerdem als Raucherentwöhnungsmittel untersucht. | Nabilon: Wird in der Onkologie zur Behandlung der Nebenwirkungen einer Chemotherapie als Antiemetikum eingesetzt. | 9-nor-9beta-Hydroxyhexahydrocannabinol (Beta-HHC) | JWH-015: Forschungschemikalie; löst Zelltod in Thymozyten aus. Ein mögliches Immunsuppressivum.[16] |
| JWH-018: in der Modedroge "Spice" als Wirkstoff nachgewiesen[13] | JWH-019: in der Modedroge "Spice" als Wirkstoff nachgewiesen[13] | JWH-073: in der Modedroge "Spice" als Wirkstoff nachgewiesen[13] | JWH-081 |
| JWH-122: in Räuchermischungen nachgewiesen[17] | JWH-133: Forschungschemikalie; zeigt entzündungs- und krebshemmende Eigenschaften in Tiermodellen.[18][19] | JWH-200 | JWH-203 |
| JWH-210 | JWH-250 | JWH-251 | JWH-398 |
| AM-2201: in Räuchermischungen nachgewiesen[17] | AM-694 | CB-25 | CB-52 |
| WIN 55,212-2 | WIN 55,212-3 | 5F-MDMB-PICA[20][21] |
Analytik der Cannabinoide
Zur zuverlässigen Analytik der Cannabinoide kann die Kopplung von HPLC und Massenspektrometrie (HPLC-MS) nach Extraktion des Probenmaterials eingesetzt werden.[22][23] Zur sicheren Identifizierung und Quantifizierung von AM-694 und seinen Metaboliten in biologischem Material kann zur Probenvorbereitung die SPE mit anschließender GC-MS oder HPLC-MS eingesetzt werden.[24]
Rechtslage
- Deutschland
Einige Cannabinoide sind dem Betäubungsmittelgesetz unterstellt bzw. fallen unter das Gesetz zur Bekämpfung der Verbreitung neuer psychoaktiver Stoffe und sind daher nur eingeschränkt oder nur mittels Rezept als Arzneimittel erhältlich.
- Schweiz
In der Schweiz muss für eine Therapie mit Dronabinol vom Arzt eine patientenspezifische Ausnahmebewilligung bei dem Bundesamt für Gesundheit (BAG) beantragt werden. Da Dronabinol keine Pflichtleistung der Krankenkassen ist, muss eine Kostenübernahme im Vorfeld und im Einzelfall abgeklärt werden; bei manchen Kassen braucht es dafür eine Zusatzversicherung.[25] Bereits über 500 Patienten mit Amyotrophe Lateralsklerose, Angststörungen, Epilepsie, Morbus Crohn, Parkinson-Krankheit, Polyarthritis, Restless-Legs-Syndrom, Tourette-Syndrom oder Tumorschmerzen profitieren von der ärztlichen Verschreibung von Cannabidiol. Multiple-Sklerose-Betroffene können das rezeptpflichtige Medikament Sativex, das CBD und THC enthält, gegen Verkrampfungen einnehmen.[26] Im Bundesamt für Gesundheit wird angenommen, dass etwa 100.000 Personen illegal Cannabisprodukte zur Selbstmedikation anwenden.[27]
Seit 2011 ist in der Schweiz Cannabisanbau mit einem THC-Gehalt bis zu 1 % zulässig, dies vor allem wegen der natürlichen Schwankungen in den Hanfpflanzen; zuvor lag der Grenzwert bei 0,3 %, der aber nicht regelmäßig eingehalten werden konnte.[28]
Literatur
- Roger Pertwee (Hrsg.): Cannabinoids. (= Handbook of Experimental Pharmacology. Band 168). Springer, Berlin / Heidelberg 2005, ISBN 3-540-22565-X.
- Roger Pertwee (Hrsg.): Endocannabinoids. (= Handbook of Experimental Pharmacology. Band 231). Springer, Berlin / Heidelberg 2015, ISBN 978-3-319-20825-1.
- Franjo Grotenhermen (Hrsg.): Cannabis und Cannabinoide. Pharmakologie, Toxikologie und therapeutisches Potential. Verlag Hans Huber, Bern / Göttingen / Toronto / Seattle 2004, ISBN 3-456-84105-1.
- Vincenzo Di Marzo (Hrsg.): Cannabinoids. Wiley-Blackwell, 2014, ISBN 978-1-118-45129-8.
- B. Chakravarti, J. Ravi, R. K. Ganju: Cannabinoids as therapeutic agents in cancer: current status and future implications. In: Oncotarget. Band 5, Nummer 15, August 2014, S. 5852–5872. PMID 25115386.
Weblinks
- Bela Szabo: Pharmacology of Cannabinoid Receptors. (PDF; 1,23 MB) In: Biotrend Reviews. No. 02, Februar 2008; BIOTREND Chemicals AG
- Marc Steffens: Modulation der neokortikalen Neurotransmission durch exogene und endogene Cannabinoide unter Berücksichtigung möglicher Speziesunterschiede zwischen Mensch und Tier. (PDF; 1,24 MB) uni-freiburg.de, Dissertation
Einzelnachweise
- ↑ a b S. Raduner, A. Majewska, J. Z. Chen, X. Q. Xie, J. Hamon, B. Faller, K. H. Altmann, J. Gertsch: Alkylamides from Echinacea are a new class of cannabinomimetics. Cannabinoid type 2 receptor-dependent and -independent immunomodulatory effects. In: The Journal of biological chemistry. Band 281, Nummer 20, Mai 2006, S. 14192–14206, doi:10.1074/jbc.M601074200. PMID 16547349.
- ↑ a b A. Ligresti, R. Villano, M. Allarà, I. Ujváry, V. Di Marzo: Kavalactones and the endocannabinoid system: the plant-derived yangonin is a novel CB? receptor ligand. In: Pharmacological Research. Band 66, Nummer 2, August 2012, S. 163–169, doi:10.1016/j.phrs.2012.04.003. PMID 22525682.
- ↑ a b G. Korte, A. Dreiseitel, P. Schreier, A. Oehme, S. Locher, S. Geiger, J. Heilmann, P. G. Sand: Tea catechins’ affinity for human cannabinoid receptors. In: Phytomedicine. Band 17, Nummer 1, Januar 2010, S. 19–22, doi:10.1016/j.phymed.2009.10.001. PMID 19897346.
- ↑ Oier Aizpurua-Olaizola, Umut Soydaner, Ekin Öztürk, Daniele Schibano, Yilmaz Simsir, Patricia Navarro, Nestor Etxebarria, Aresatz Usobiaga: Evolution of the Cannabinoid and Terpene Content during the Growth of Cannabis sativa Plants from Different Chemotypes ACS Publications, J. Nat. Prod., 2016, 79 (2), S. 324–331, doi:10.1021/acs.jnatprod.5b00949.
- ↑ Y. Gaoni, R. Mechoulam: Isolation, Structure, and Partial Synthesis of an Active Constituent of Hashish. In: Journal of the American Chemical Society. 86, 1964, S. 1646, doi:10.1021/ja01062a046.
- ↑ R. Mechoulam: Plant cannabinoids: a neglected pharmacological treasure trove. In: British Journal of Pharmacology. Band 146, Nummer 7, Dezember 2005, S. 913–915, doi:10.1038/sj.bjp.0706415. PMID 16205721, PMC 1751232 (freier Volltext).
- ↑ Roger G. Pertwee: Pharmacological and therapeutic targets for Δ⁹-tetrahydrocannabinol and cannabidiol. In: Euphytica. 140, 2004, S. 73, doi:10.1007/s10681-004-4756-9.
- ↑ a b wahrscheinlich Oxidationsartefakte Tetrahydrocannabinols bzw. Cannabidiols.
- ↑ Table of Natural Cannabinoids
- ↑ J. Gertsch, M. Leonti, S. Raduner, I. Racz, J. Z. Chen, X. Q. Xie, K. H. Altmann, M. Karsak, A. Zimmer: Beta-caryophyllene is a dietary cannabinoid. In: Proceedings of the National Academy of Sciences. Band 105, Nummer 26, Juli 2008, S. 9099–9104, doi:10.1073/pnas.0803601105. PMID 18574142, PMC 2449371 (freier Volltext).
- ↑ R. Mechoulam, L. A. Parker: The endocannabinoid system and the brain. In: Annual review of psychology. Band 64, 2013, S. 21–47, doi:10.1146/annurev-psych-113011-143739. PMID 22804774 (Review).
- ↑ A. C. Porter, J. M. Sauer u. a.: Characterization of a novel endocannabinoid, virodhamine, with antagonist activity at the CB1 receptor. In: The Journal of pharmacology and experimental therapeutics. Band 301, Nummer 3, Juni 2002, S. 1020–1024. PMID 12023533.
- ↑ a b c d Bernd Dicks: Erste Analyse: Modedroge Spice enthält Haschisch-artigen Wirkstoff. In: Spiegel Online. 15. Dezember 2008, abgerufen am 4. Juni 2015.
- ↑ NIH: Synthetic Cannabinoids, Forensic & Legal Aspects ( vom 22. März 2016 im Internet Archive; PDF; 3 MB, englisch)
- ↑ Modedroge: Hauptwirkstoff von Spice entdeckt. In: Frankfurter Rundschau. 19. Januar 2009, abgerufen am 1. Juli 2012.
- ↑ C. Lombard, M. Nagarkatti, P. Nagarkatti: CB2 cannabinoid receptor agonist, JWH-015, triggers apoptosis in immune cells: potential role for CB2-selective ligands as immunosuppressive agents. In: Clinical immunology (Orlando, Fla.). Band 122, Nummer 3, März 2007, S. 259–270, doi:10.1016/j.clim.2006.11.002. PMID 17185040. PMC 1864948 (freier Volltext).
- ↑ a b Stefan Kneisel, Folker Westphal u. a.: Trends auf dem Gebiet der synthetischen Cannabinoidmimetika: Massenspektren und ATR-IR-Spektren neuer Verbindungen aus dem Zeitraum Ende 2010 bis Ende 2011. (PDF; 476 kB) In: Toxichem Krimtech. 78(3), 2011, S. 465.
- ↑ C. Blázquez, M. L. Casanova, A. Planas, T. Gómez Del Pulgar, C. Villanueva, M. J. Fernández-Aceñero, J. Aragonés, J. W. Huffman, J. L. Jorcano, M. Guzmán: Inhibition of tumor angiogenesis by cannabinoids. In: The FASEB Journal: official publication of the Federation of American Societies for Experimental Biology. Band 17, Nummer 3, März 2003, S. 529–531, doi:10.1096/fj.02-0795fje. PMID 12514108.
- ↑ H. Xu, C. L. Cheng u. a.: Anti-inflammatory property of the cannabinoid receptor-2-selective agonist JWH-133 in a rodent model of autoimmune uveoretinitis. In: Journal of Leukocyte Biology. 82, 2007, S. 532–541, doi:10.1189/jlb.0307159.
- ↑ Warnung Cannabis mit synthetischen Cannabinoiden. 13. Februar 2020, abgerufen am 6. März 2020.
- ↑ 5-fluoro MDMB-PICA - Item No. 20803. In: caymanchem.com. Abgerufen am 6. März 2020 (englisch).
- ↑ S. Kneisel, V. Auwärter: Analysis of 30 synthetic cannabinoids in serum by liquid chromatography-electrospray ionization tandem mass spectrometry after liquid-liquid extraction. In: J Mass Spectrom. 47(7), Jul 2012, S. 825–835. PMID 22791249.
- ↑ Voegel CD, Baumgartner MR, Kraemer T, Wüst S, Binz TM: Simultaneous quantification of steroid hormones and endocannabinoids (ECs) in human hair using an automated supported liquid extraction (SLE) and LC-MS/MS - Insights into EC baseline values and correlation to steroid concentrations., Talanta. 2021 Jan 15;222:121499, PMID 33167212.
- ↑ E. Bertol, F. Vaiano, M. G. Di Milia, F. Mari: In vivo detection of the new psychoactive substance AM-694 and its metabolites. In: Forensic Sci Int. 256, Nov 2015, S. 21–27. PMID 26295909.
- ↑ haenseler.ch: Therapie mit Cannabinoiden ( vom 1. August 2012 im Webarchiv archive.today)
- ↑ panakeia.ch: Dronabinol/Cannabis ( vom 20. Juli 2017 im Internet Archive)
- ↑ Simon Christen: Fürchtet sich die Pharmaindustrie vor dem Erfolg von Cannabis? DOK SRF, Zürich 7. April 2017
- ↑ Rebekka Haefeli: Jetzt kommt Cannabis light. Für Kiffer eine Riesenenttäuschung, für Pflanzer die grosse Hoffnung: THC-armes Cannabis. Der Handel mit dem Kraut könnte sich zu einem Milliardengeschäft entwickeln. Beobachter, Zürich, 7. Juli 2017, S. 36–40.