Usuario:Andresisrael/Zona de Pruebas 3
| Monito del monte | ||
|---|---|---|
 | ||
| Estado de conservación | ||
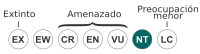 Casi amenazado (UICN) | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Subfilo: | Vertebrata | |
| Clase: | Mammalia | |
| Subclase: | Theria | |
| Infraclase: | Marsupialia | |
| (sin rango): | Australidelphia | |
| Superorden: | Microbiotheria | |
| Orden: | Microbiotheria | |
| Familia: | Microbiotheriidae | |
| Género: | Dromiciops | |
| Especie: |
Dromiciops gliroides Thomas, 1894 | |
| Distribución | ||
|
Mapa de distribución de Dromiciops gliroides Mapa de distribución de Dromiciops gliroides | ||
| Sinonimia | ||
Dromiciops australis | ||
El monito del monte (Dromiciops gliroides), también llamado chumaihuén, es un marsupial del sudoeste de la Argentina y el sur de Chile. Se destaca por ser el único representante del orden Microbiotheria, el cual está más emparentado con los marsupiales de Australia que con los otros marsupiales de América del Sur.
Es considerado un fósil viviente, ya que todos los otros miembros conocidos del orden se extinguieron entre el Oligoceno y el Mioceno. Se ignora si los remotos ancestros del monito del monte llegaron a América desde Australia a través de la Antártida, o bien se encontraban allí desde la época en que ambos continentes estaban unidos formando Gondwana.
Debido a la fragmentación, destrucción y degradación de su habitad
General:
- Macroscopia: [2]
Taxonomía
Historia evolutiva
Descubrimiento y filogenia
Philips et al 2006 El primer registro del monito del monte en la literatura cintífica se remonta a 1871, cuando Robert Oliver Cunningham
La especie fue descrita en 1894 por Oldfield Thomas, un zoólogo inglés, bajo el nombre Dromiciops gliroides en la revista Annals and Magazine of Natural Historynota. En ella, Thomas señala que el nombre proviene de su semejanza con el marsupial Dromicia nana, —renombrado como Cercartetus lepidus—.
otros:
2) http://webhost.ua.ac.be/funmorph/raoul/fylsyst/Nilsson2004.pdf Relaciones con marsupiales autralianos.
3)http://rsbl.royalsocietypublishing.org/content/3/3/318.full.pdf RELATIONSHIPS
4)http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1689543/pdf/9921677.pdf filogenia
5)Mammals of South America, Vol. Volume I: Marsupials, Xenarthrans, Shrews, and Bats Subespecies falsas
Anatomía y fisiología
- [8]:Dental anomalies in Dromiciops gliroides (Microbiotheria, Microbiotheriidae),
- Herzinhter 1999[9]:Dromiciops gliroides Thomas, 1894, last of the Microbiotheria (Marsupialia), with a review of the family Microbiotheriidae
- Cortés et al 2008, Bioenergetics and inter-individual variation in physiological capacities in a relict mammal – the Monito del Monte (Dromiciops gliroides) [10]
- Whiters et al 2012 Evaporative water loss, relative water economy and evaporative partitioning of a heterothermic marsupial, the monito del monte (Dromiciops gliroides) (falta de control de perdida de agua) (hibernación)
Hábitad y distribución
Dromiciops gliroides es endémico de los bosques templados del norte de la Patagonia de Chile y Argentina. Su distribución geográfica abarca desde la Reserva Nacional Los Ruiles en la Región del Bío-Bío por el norte, hasta la desembocadura del río Inio en la isla de Chiloé por el oeste y sur, y hasta el paso fronterizo Pino Hachado por el este.[1] En Argentina se encuentra en las provincias de Rio Negro y Neuquén, además del noroeste de la provincia de Chubut.[2] La ditribución del monito del monte ha estado en constante crecimiento desde 1870, ya que diversos estudios han registrado nuevas localidades en donde el marsupial habita.[2][3][4] En 2010 un estudio recopiló y analizó estos registros, conformando el modelo distributivo actual. Dromiciops gliroides ha sido documentado en más de 88 localidades desde su descubrimiento, la mayoría de ellas en Chile.[1]
La especie reside en la zona norte y central de la ecorregión bosque templado valdiviano en donde habita, principalemte, en las subregiones bosque andino —con asociaciones de Nothofagus-Fitzroya y Nothogafus-Araucaria—, bosque maulino costero y bosque valdiviano, que conforman el 80% del habitad de la especie.[1] Dromiciops gliroides prefiere los bosques primarios humedos, fríos y con asociaciones de Notofagásea y Araucaria, y evita en lo posible secundarios y matorrales. En 2009, un estudio de telemetría mostró que el uso de hábitad corresponde en un 97% a bosques primarios, un 2% a bosques secundarios y un 1% a matorrales.[5]
La presencia de monitos del monte esta directamente relacionada con la de ciertas plantas con las cuales presenta una relación de simpatría. La abundancia de Dromiciops gliroides decae si el porcentaje de cobertura de caña de colihue (Chusquea culeou) es menor al 10%. Una vez que los requerimientos de colihue se cumplen, la presencia de monitos del monte depende de la disponibilidad de frutos de quintral (Tristerix corymbosus). Áreas con más del 10% de colihue, pero con nula presencia de quintral presencian entre 5 y 7 individuos por hectárea. En cambio, áreas con la misma cantidad de colihue, pero con abundante quintral albergan hasta 25 individuos por hectárea.[6]
Un estudio del 2011 Dromiciops gliroides habita
- [11] Presence of Dromiciops gliroides (Microbiotheria: Microbiotheriidae) in the deciduous forests of central Chile
- [12] Presence of Dromiciops gliroides (Microbiotheria: Microbiotheriidae) in the deciduous forests of central Chile
- Rodriguez Cabal et al 2008 Population characterisitcs of Dromiciops gliroides an endemic marsupial of the temperate forest of Patagonia
- Rodriguez-Cabal & Branch 2011. Influence of habitat factors on the distribution and abundance of a marsupial seed disperser [14]
- Celis-Diez et al 2012 Population abundance, natural history, and habitat use by the arboreal marsupial Dromiciops gliroides in rural Chiloé Island, Chile [15]
- Smith-Ramírez et al. 2010 Habitat use of remnant forest habitats by threatened arboreal marsupial Dromiciops gliroides (Microbiotheria) in a rural landscape of southern Chile [16]
new
- Ecological consistency across space: a synthesis of the ecological aspects of Dromiciops gliroides in Argentina and Chile [17]
- Morphology and Systematics of the Mite Subfamily Dromiciocoptinae (Acari: Myocoptidae), with Description of Two New Species??? [18]
- Loxodontomys micropus (Rodentia: Cricetidae): ¡¡¡Parasito??? [19]
- reapeteviloty [20]
- http://www.degruyter.com/view/j/mamm.2005.69.issue-3-4/mamm.2005.027/mamm.2005.027.xml Abund. micromam.
Comportamiento
- Nespolo et al 2010 Bioenergetics of torpor in the microbiotherid marsupial, monito del monte (Dromiciops gliroides): the role of temperature and food availability. [21]
- Bozinovic et al 2004 Energetics and torpor of a South American “living fossil”, the microbiotheriid Dromiciops gliroides
Son animales de hábitos nocturnos y arborícolas, que construyen nidos esféricos con hojas de quilas (Chusquea quila). En ellos se refugian mientras las condiciones climáticas son adversas. No obstante, cuando éstas son extremadamente rigurosas, como es costumbre en el invierno austral en los Andes, estos animales hibernan hasta la primavera.
También son utilizados para albergar las crías una vez que han sido destetadas. Los nidos son encaramados entre la vegetación a aproximadamente 2 m de altura. También aprovechan otros abandonados por aves u otros animales e incluso hacerlos en huecos de troncos caídos, impermeabilizando las paredes de los mismos con hojas frescas.
Parece ser que sólo forman parejas durante la época de celo, y el resto del año, las únicas asociaciones existentes en esta especie son las de la madre con la cría.
Comunicación
Reproducción
- Muñoz-Pedreros et al 2005 Reproduction and development of Dromiciops gliroides (Marsupialia: Microbiotheriidae) in temperate rainforests of southern Chile [22]
Las hembras paren en primavera camadas de 1 a 4 crías que amamantan en los cuatro pezones protegidos por un marsupio pequeño pero con gran capacidad de distensión abierto hacia atrás. Una vez que las crías se sueltan del pezón, son cobijados en una madriguera a la que regresa la madre para alimentarlos, cuando no los lleva sobre su cuerpo como ocurre con otros marsupiales americanos. Ambos sexos alcanzan la madurez sexual en el segundo año de vida, manteniendo relación con la madre hasta ese momento.
Dieta
Dromiciops gliroides es un omnívoro generalista, es decir, necesita artrópodos (ricos en proteínas) y frutos (ricos en azúcares) para abastecer sus requerimientos nutricionales. Si bien la dieta de D. gliroides se consideraba principalmente insectívora, estudios recientes han demostrado que es más frugívora de lo que se pensaba. ref2012 La dieta del marsupial varía estacionalmente, probablemente debido a la disponibilidad. En verano cuando la presencia de frutos es mayor, el consumo de frutos aumenta. En cambio, en primavera la dieta de D. gliroides pasa a ser más insectívora, debido en parte a la necesidad de una dieta alta en proteínas para el apareo. Además, una dieta rica en frutos a fines del verano podría estar relacionada con la necesidad de almacenar grasa y azúcares para el invierno.[7][8]
Un estudió analizó las proporciones dietarias de las poblaciones de monitos del monte en Chiloé mediante estudios de muestras fecales, tanto en bosques primarios (BP) como en bosques de tala selectiva (BTS). Los artrópodos representaron más de un 40 % de los elementos encontrados y fueron la principal fuente de alimento tanto en BP como en BTS, aunque su presencia fue mayor en este último. Según el estudio esto se debió a que en ese tipo de bosque los doseles arbóreos son más abiertos, lo que aumenta la cobertura de caña, donde estos insectos habitan. Coleoptera y Orthoptera fueron los artrópodos más frecuentes, con una presencia en 43 % y 25 % de las muestras, respectivamente. Otros taxones, como Lepidoptera, Hymenoptera y Hemiptera también fueron encontrados, aunque en menor frecuencia. Por otro lado, se encontraron las semillas de 12 plantas diferentes, entre ellas epifitas, enredaderas, y arbustos.[7] Otro estudio analizó la dieta de D. gliroides cerca de Valdivia y llegó a resultados similares. Los invertebrados correspondieron a un 79,7 % de la dieta y abundaron en primavera, decreciendo su consumo en verano y otoño. En cambio, los frutos abundaron en verano y su consumo varió de forma inversa.[9]
Si bien D. gliroides necesita una dieta omnívora, exhibe una serie de plasticidades fenotípicas en función de la dieta consumida —insectivora, frugívora o mixta—. El consumo de oxígeno aumenta durante una dieta especifica, ya sea de insectos o frutos. La perdida de agua evaporativa es mayor en una dieta frugívora, decreciendo en una dieta mixta y llegando a su punto más bajo durante una dieta insectívora. En cambio, el hígado —el órgano encargado de metabolizar las proteínas y las grasas— aumenta de tamaño durante una dieta insectívora. El intestino delgado también aumentó de tamaño en esa dieta, probablemente para mejorar la digestión de proteínas y otros elementos presentes en artrópodos, como los exoesqueletos. La producción de enzimas digestiva también depende de la alimentación del monito del monte. En una dieta insectívora la síntesis de aminopeptidasa N incrementa, especialmente en la última parte del tracto intestinal. En cambio, durante una dieta frugívora, la síntesis de maltasa y sacarasa se dispara.[9]
[8]
[9]
[9]
Rol ecológico
Dromiciops gliroides es el principal dispersor de semillas de al menos 16 especies de plantas diferentes. Seis de ellas son dispersadas únicamente por el monito del monte: Tristerix corymbosus, Asteranthera ovata, Cissus striata, Desfontainia spinosa, Luzuriaga sp., Mitraria coccinea. El resto, en cambio, también es dispersado por aves frugívoras como el fio-fio (E. albiceps). y el zorzal chileno (T. falcklandii) Cabe destacarse su relación mutualista con el quintral (Tristerix corymbosus). Esta hemiparásita posee un rol vital para la conservación de los bosques templados de la Patagonia. Aparte de ser un factor de mortalidad para las plantas hospedadoras, su néctar es la principal fuente de alimento del picaflor rubí (Sephanoides sephanoides) durante los meses de invierno. A su vez, S. sephanoides es el único polinizador de un gran número de plantas, incluido T. corymbosus.[8][10]
D. gliroides dispersa semillas de frutos que otros animales rechazarían debido a su color o tamaño. Por ejemplo, E. albiceps y T. falcklandii, las principales aves dispersoras en los bosques del sur de Chile, solo pueden consumir frutos de hasta cierto tamaño, 8 mm y 11 mm respectivamente. El monito del monte, por otro lado, puede alimentarse de frutos de más de 11 mm. Se ha documentado una relación entre el tipo de dispersor de un planta y el color de la fruta que produce. Las especies dispersadas por mamíferos son generalmente verdes, en cambio, las dispersadas por aves son de colores más fuertes, como amarillo, rojo y negro. Esta relación es particularmente evidente en el caso de T. corymbosus. Los especímenes ubicados en el norte, en los matorrales chilenos, exhiben una coloración amarilla. En cambio, los que habitan en el sur, en los bosques templados, exhiben una coloración verde. Se ha propuesto que la necesidad de atraer a ciertas aves causa que algunas plantas provean a sus frutos de colores más vistosos. Eso explicaría que en su ditribución más austral, T. corymbosus presente frutos verdes; el monito del monte no discrimina en función del color ya que es un animal nocturno.[10][11]
La efectividad del monito del monte como dispersor de semillas ha sido confirmada en varios estudios. Es capaz de ingerir semillas y después expulsarlas sin causarles ningún daño, por el contrario, ayuda a su germinación y les confiere un abono natural. De hecho, estudios han demostrado que las semillas de T. corymbosus, A. chilensis y A. microphylla que han pasado por el tubo digestivo del monito del monte presentan mayores índices de germinación que las plantadas directamente en el sustrato. Además, el rol del monito del monTe es especialmente evidente en el caso de las hemiparasitas, como T. corymbosus, ya que necesitan germinar sobre algún tronco o rama. Un estudio mostró que solo el 10% de las semillas defecadas por D. gliroides cayó al suelo, el 90% germinó, y la mayoría desarrolló rizoides, una especie de raiz con la cual las hepiparásitas se fijan a su hospedador.[10][12]
- Amico et al 2009, The potential key seed-dispersing role of the arboreal marsupial Dromiciops gliroides[23]
- Franco et al. 2011 Communal nesting, activity patterns, and population characteristics in the near-threatened monito del monte, Dromiciops gliroides [24]
- García et al. (2009) Seed dispersal by a frugivorous marsupial shapes the spatial scale of a mistletoe population [25]
Depredadores y parasitos
Los principales depredadores del monito del monte son mamíferos y aves, tanto introducidos como nativos, aunque el gato domestico (Felix silvestris catus) es el principal depredador. Estudios han determinado que el monito del monte corresponde al 10% de la dieta del zorro chilla (Lycalopex griseus),[13] al 3,6% de la del zorro chilote (Lycalopex fulvipes)[14] y a una pequeña parte de la dieta de la lechuza común (Tyto alba).[15] Sin embargo, el hábitad del marsupial posee altas concentraciones de caña colihue, lo que lo oculta de posible depredadores. Además, al ser un animal arbóreo, las posibilidades de encontrarse con algún depredador terrestre son escasas. También se ha sugerido que la secreción que el monito del monte secreta de sus glándulas cutáneas es capaz de repeler depredadores.[16][17]
Cuatro taxones de ectoparásitos han sido encontrados en Dromiciops gliroides: Siphonaptera (pulgas), Laelapidae (ácaros), Ixodoidea (garrapatas) y Hirudinea (sanguijuelas). Entre las especies de sifanópteros identificadas están Chiliopsylla allophyla y Plocopsylla diana.[7] Entre los ácaros, solo una ha sido reconocida, Acanthochela chilensis.[18] Por otro lado, Ixodes neuquenensis es la única garrapata identificada como parásito de D. gliroides.[19][20] Si bien la presencia de sanguijuelas en el monito de monte se encentra bien documentada, no se ha identificado ninguna especie aún.[7] En 2012 un estudio analizó a 185 individuos en busca de ectoparásitos, de los cuales 102 los poseían, es decir el 55%. El estudio mostró que la presencia de parásitos es mayor en bosques de tala selectiva que en bosques primarios, y mayor en ejemplares jóvenes que en adultos. Además la prevalencia de garrapatas fue mayor en primavera que en verano. El sexo no incidió en la presencia de parásitos. El estudió concluyó, basándose en el peso, índices de recaptura y densidad de población, que los parásitos no afectaron la salud de los monitos del monte.[7]
Solo dos especies de endoparásitos han sido encontradas en el monito del monte: Allassogonoporus dromiciops, perteneciente al taxón Digenea y Pterigodermatites (Paucipectines) spinicaudatis, perteneciente al taxón Nematoda. El primero es el único Allassogonoporus en Sudamérica y el único que parasita a un marsupial. El resto de las especies del género afectan a murciélagos y roedores de Norteamérica, Europa y el Sudeste Asiático. Por otro lado, P. spinicaudatis no esta presente en ningún marsupial australiano, pero si en varios americanos.[21][22]
En 2009, un estudio descubrió varios Hepatozoon, un género de protozoos, hospedados en los eritrocitos del monito del monte. Estos poseen un ancestro común con varios otros Hepatozoon encontrados en roedores, reptiles y anfibios. Sin embargo son filogenéticamente distintos a otros encontrados en el orden Carnivora. También son distintos a Hepatozoon presentes en otros micromamíferos simpatricos y en un marsupial australiano (Isoodon obesulus). El estudio sugiere que el parásito Ixodes neuquenensis fue el vector común de infección. El protozoo fue encontrado en 35 de los 75 individuos analizados. La infección fue más difícil de identificar en monitos del monte adultos, lo que implica que los ejemplares jóvenes son más vulnerables a contagiarse del protozoo. Estos Hepatozoon son una amenaza para el marsupial ya que podrían inducir la aparición de otras enfermedades.[23]
Conservación
Abundancia
Dromiciops gliroides es clasificado como «casi amenazado» por la Lista Roja de la UICN, debido a un continuo declive en su población.[24] En 2007, fue clasaficado como «inadecuadamente conocido» en el Decreto N° 151 del Ministerio Secretaría General de la Presidencia de Chile que juzgó la información existente como insuficiente, pese a que se sospechó de una situación de amenaza.[25] En un principio D. gliroides fue considerada una especie rara. De hecho, hasta el 2008, la UINC la clasificó como vulnerable.[24] Esto se debió a su baja abundancia durante estudios anteriores al siglo XXI en poblaciones de micromamíferos. Sin embargó, el tipo y la altura de las trampas usadas fueron las causas principales de este bajo índice poblacional. Estos estudios utilizaron trampas Sherman colocadas en el suelo, las cuales son ineficaces en la captura de animales arbóreos. Otro factor importante es el tipo de cebo. Comúnmente se usa avena, la cual no es efectiva en mamíferos frugívoros-insectívoros.[26][27]
No sería hasta el 2009 cuando se estudiaron métodos no convencionales destinados directamente a la captura del monito del monte. Estos estudios concluyeron que la forma más eficaz para capturar a D. gliroides es una combinación de trampas de captura viva de malla colocadas a altura con un cebo de plátano. Gracias a estos avances se descubrió que D. gliroides es más común de lo que se pensaba.[26][27] Si bien algunas áreas han sido bien estudiadas, se desconoce mucho sobre poblaciones en el resto de su distribución geográfica.[8] En un área, cercana al Parque nacional Vicente Pérez Rosales, se registró una densidad promedio de 27 individuos por hectárea (ind/ha) en bosques primarios y 19 ind/ha en bosques secundarios.[26][27] En otra población, en un bosque secundario al norte de Valdivia, se registró una densidad de 26 ind/ha.[28] En cambio, en un bosque primario cercano a Bariloche, se estimó una densidad de 27 ind/ha.[29] En Chiloé, por otro lado, la abundancia es menor; un estudio realizado el 2012 registró una densidad de 6 ind/ha en bosques primarios y 8 ind/ha en bosques secundarios. Este estudio concluyó que no existen diferencias entre poblaciones en bosques primarios y en bosques secundarios afectados por la tala selectiva.[7]
Amenazas
Las principales amenazas del monito del monte son la degradación, fragmentación y destrucción de su hábitad, el bosque templado valdiviano.[8] Este bosque a sido reducido drásticamente en el último siglo, a tal punto que solo el 30 % permanece intacto.[30] La actividad maderera y agrícola han sido la causa principal de este daño.[24][8] En la parte norte de la distribución del monito del monte, especies exóticas como el Pinus radiata han remplazado progresivamente a los bosque nátivos.[31] En el sur la actividad ganadera ha degradado significativamente el suelo, por lo que miles de hectáreas de bosque nativo han sido remplazadas por pastizales.[32] Usualmente se talan los arboles autóctonos mas grandes y longevos debido a su alto valor comercial. Después se sigue con los troncos caídos, que son usados comúnmente como leña. Lo que queda es comido o pisoteado por el ganado, lo que impide que el bosque se regenere.[8]
Las actividades antropogénicas usualmente degradan el hábitat del monito del monte, ya que alteran factores esenciales para su conservación como el diámetro y densidad de las ramas y la diversidad de plantas.[33] Además, remueven las ramas en el suelo y la caña de colihue, donde el marsupial nidifica.[8] La falta de vegetación como enredaderas y plantas en el sotobosque podría disminuir la disponibilidad de alimento y la movilidad del monito del monte.[33] Los bosques degradados usualmente poseen un dosel arbóreo menos frondoso, lo que aumenta la exposición al sol y forma microclimas más secos.[8]
El monito del monte es afectado de forma negativa por la fragmentación de su hábitad. Diversos estudios han mostrado que el marsupial evita en lo posible transitar por pastizales, por la que es poco probable que pase de un fragmento de bosque a otro. Esto aislaría a las poblaciones de monito del monte y causaría un cuello de botella que probablemente terminaría en un colapso genético o demográfico.[5] En bosques fragmentados la presencia de depredadores a aumenta debido al efecto de borde. Además se ha documentado una reducción en la capacidad del monito del monte para dispersar semillas en esos bosques.[34]
En la cultura
Al ser una especie poco conocida y difícil de encontrar, el monito del monte ha estado rodeado de un halo de misterio y se le han atribuido características fantásticas.
Supersticiones de algunas partes de su área de distribución mantienen que ver ejemplares de esta especie o tenerlos en casa dará mala suerte a las personas, habiendo constancia de que vecinos de las regiones que estos animales ocupan han llegado a echar abajo su casa al ver uno de estos pequeños marsupiales en el interior.
Los nombres que se le otorgan, chumaihuén y perrito de virtud, les confieren poderes benéficos. El chumaihuén de las historias es muy semejante al animal auténtico, pero con cola de buey y capaz de sobrevivir sólo con azúcar; se le atribuye un origen relacionado con el buey que presenció el nacimiento de Jesús. El nombre perrito de virtud proviene de la creencia extendida por Chiloé de que son perros mágicos de los bosques, que habitan dentro de los troncos de los árboles y pueden vivir de la "virtud", es decir, nutrirse del aire sin tomar otro alimento. Se cree que da buena suerte oír sus débiles gritos, semejantes a los de cachorros de perro recién nacidos, y que no debe hacérseles daño porque sería una mala acción.
En tanto, el nombre colocolo alude a un ser maligno de la mitología mapuche, descrito por Manuel Rojas en su cuento "El colocolo" como "un ratón que nace de un huevo de gallina empollado por una serpiente" y que succiona la saliva de los moradores de una vivienda, a semejanza del basilisco chilote.
Por su aspecto muchas veces es confundido con la yaca (Thylamys elegans).
Véase también
Referencias
- ↑ a b c Martin, Gabriel M. (2010). «Geographic distribution and historical occurrence of Dromiciops gliroides Thomas (Metatheria: Microbiotheria)». Journal of Mammalogy (en inglés) 91 (4): 1025-1035. doi:10.1644/09-MAMM-A-347.1.
- ↑ a b Martin, Gabriel M. (2003). «Nuevas localidades para marsupiales patagónicos (Didelphimorphia y Microbiotheria) en el noroeste de la provincia del Chubut, Argentina». Maztozoología neotropical (en inglés) (Instituto Argentino de Investigación de las Zonas Aridas) 10 (1): 148-153.
- ↑ Lobos, R. E.; Carrier, A.; Carrasco, G.; Palma (2005). «Presence of Dromiciops gliroides (Microbiotheria: Microbiotheriidae) in the deciduous forests of central Chile». Mammalian Biology (en inglés) 70: 376-380.
- ↑ Greer, J. K. (1965). «Mammals of Malleco Province, Chile». Publications of the Museum. Michigan State University Biological Series (en inglés) 3: 81-144.
- ↑ a b Fontúrbel, Francisco E.; Silva-Rodríguez, Eduardo A.; Cárdenas, Nelson H.; Jiménez, Jaime E. (2010). «Spatial ecology of monito del monte (Dromiciops gliroides) in a fragmented landscape of southern Chile» (pdf). Mammalian Biology (en inglés) 75 (1): 1-9. doi:10.1016/j.mambio.2009.08.004.
- ↑ Rodriguez-Cabal, Mariano A.; Branch, Lyn C. (2011). «Influence of habitat factors on the distribution and abundance of a marsupial seed disperser». Journal of Mammalogy (en inglés) (American Society of Mammalogists) 96: 1245-1252. doi:10.1644/10-MAMM-A-315.1.
- ↑ a b c d e f Celis-Diez, Juan L.; Hetz, Jennifer; Marín-Vial, Paula A.; Fuster, Gonzalo; Necochea, Pablo; Vásquez, Rodrigo A.; Jaksic, Fabián M.; Armesto, Juan J. (2012). «Population abundance, natural history, and habitat use by the arboreal marsupial Dromiciops gliroides in rural Chiloé Island, Chile» (pdf). Journal of Mammalogy (en inglés) (American Society of Mammalogist) 93 (1): 134-148. doi:10.1644/10-MAMM-A-406.1.
- ↑ a b c d e f g h i Fontúrbel, Francisco E.; Franco, Marcela; Amico, Guillermo C. (2012). «Ecological consistency across space: a synthesis of the ecological aspects of Dromiciops gliroides in Argentina and Chile». Naturwissenschaften (en inglés) 99. doi:10.1007/s00114-012-0969-2.
- ↑ a b c d Cortés, Pablo A.; Franco, Marcela; Sabat, Silvia; Quijano, A.; Nespolo, Roberto F. (2011). «Bioenergetics and intestinal phenotypic flexibility in the microbiotherid marsupial (Dromiciops gliroides) from the temperate forest in South America». Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology (en inglés) 160 (2): 117-124. doi:10.1016/j.bbr.2011.03.031. Error en la cita: Etiqueta
<ref>no válida; el nombre «cortes2011» está definido varias veces con contenidos diferentes - ↑ a b c Amico, Guillermo C.; Rodríguez-Cabal, Mariano A. (2009). «The potential key seed-dispersing role of the arboreal marsupial Dromiciops gliroides». Acta Oecologica (en inglés) 35 (8-13).
- ↑ Amico, Guillermo C.; Rodríguez-Cabal, Mariano A. (2011). «Geographic variation in fruit colour is associated with contrasting seed disperser assemblages in a south-Andean mistletoe». Ecography (en inglés) 34: 318-326.
- ↑ Amico, Guillermo C.; Aizen, Marcelo A. (2000). «Mistletoe seed dispersal by a marsupial» (pdf). Nature (en inglés) 408: 929-930.
- ↑ Rau, J.; Martinez, D.; Low, J.; Tilleria, M. (1995). «Predation by gray foxes (Lycalopex griseus) on cursorial, scansorial, and arboreal small mammals in a protected wildlife area of southern Chile». Revista Chilena de Historia Natural (en inglés) 68 (3): 333-340.
- ↑ Jaksic, F.; Jimenez, J.; Medel, R.; Marquet, P. (1990). «Habitat and diet of Darwin's fox (Pseudalopex fulvipes) on the Chilean mainland». Journal of Mammalogy (en inglés) 71 (2): 246-248.
- ↑ Trejo, A.; Ojeda, V. (2004). «Diet of barn owls (Tyto alba) in forested habitats of northwestern Argentine Patagonia». Ornitologia Neotropical (en inglés) 15 (3): 307-311.
- ↑ Mann, G. (1955). «Monito del monte Dromiciops australis Philippi.». Investigaciones Zoológicas Chilenas (en inglés) 2 (9): 159-166.
- ↑ Kelt, D.; Martinez, D. (1989). «Notes on distribution and ecology of two marsupials endemic to the Valdivian forests of southern South America». Journal of Mammalogy (en inglés) 70 (1): 220-224.
- ↑ Lareschi, Marcela; González-Acuña, Daniel (1992). «Acari, Laelapidae (ectoparasitic mites), central and southern Chile» (pdf). Check List [online] (en inglés) 4. ISSN 1809-127X.
- ↑ Ringuelet, R. (1947). «La supuesta presencia de Ixodes brunneus Koch en la Argentina y descripción de una nueva garrapata Ixodes neuquenensis nov. sp.» (pdf). Notas Mus. La Plata 12 (4): 207-216.
- ↑ Marín-Vial, Paula; González-Acuña, Daniel; Celis-Diez, Juan L.; Cattan, Pedro E.; Guglielmone, Alberto A. (2007). «Presence of Ixodes neuquenensis Ringuelet, 1947 (Acari: Ixodidae) on the endangered Neotropical marsupial Monito del monte (Dromiciops gliroides Thomas, 1894, Microbiotheria: Microbiotheriidae) at Chiloé Island, Chile». European Journal of Wildlife Research (en inglés) 53: 73-75.
- ↑ Mann, G. (1992). «Pterigodermatites (Paucipectines) spinicaudatis n.sp. (Nematoda: Rictularidae) from Dromiciops australis (Marsupialia: Microbiotheriidae) in Bariloche, Rio Negro, Argentina, biogeographical distribution and host-parasite relationships» (pdf). Mem. Inst. Oswaldo Cruz [online] (en inglés) 87 (4): 533-538. doi:10.1590/S0074-02761992000400011.
- ↑ Brugni, Norma; Flores, Verónica R. (2007). «Allassogonoporus dromiciops n. sp. (Dignea:Allagssogonoporidae) from Dromiciops gliroides (Marsupialia:Microbiotheriidae) in Patagonia, Argentina». Syst Parasitol (en inglés) 68: 45-48. doi:10.1007/s11230-006-9083-1.
- ↑ Merino, S.; Vásquez, R. A.; Martínez, J.; Celiz-Diez, J. L.; Gutiérrez-Jiménez, L.; Ippi, S.; Sánchez-Monzalvez, I.; Mártinez-de la Puente, j. (2009). «Molecular characterization of an ancient Hepatozoon species parasitizing the ‘living fossil’ marsupial Monito del Monte Dromiciops gliroides from Chile» (pdf). Biological Journal of the Linnean Society (en inglés) 98 (3): 568-576. doi:10.1111/j.1095-8312.2009.01302.x.
- ↑ a b c Diaz, M. & Teta, P. (2008). «Dromiciops gliroides». Lista Roja de especies amenazadas de la UICN 2012.2 (en inglés). ISSN 2307-8235. Consultado el 28 de noviembre de 2012.
- ↑ «Dromiciops gliroides (Thomas, 1894)». Inventario Nacional de Especies. Consultado el 29 de noviembre de 2012.
- ↑ a b c Fontúrbel, F.; Jiménez, J. E. (2009). «Underestimation of abundances of the monito del monte (Dromiciops gliroides) due to a sampling artifact». Journal of Mammalogy (en inglés) 90 (6): 1357-1362. doi:10.1644/09-MAMM-A-027R1.1.
- ↑ a b c Fontúrbel, F. (2010). «A methodological approach to assess the small mammal community diversity in the temperate rainforest of Patagonia» (pdf). Mammalian Biology (en inglés) 90 (75): 290-301.
- ↑ Franco, Marcela; Quijano, Andrea; Soto-Gamboa, Mauricio (2011). «Communal nesting, activity patterns, and population characteristics in the nearthreatened monito del monte, Dromiciops gliroides». Journal of Mammalogy (en inglés) 92 (5): 994-1004. doi:10.1644/10-MAMM-A-256.1.
- ↑ Rodríguez-Cabal, Mariano A.; Amico, Guillermo C. Amico; Novaro, Andrés J. (2008). «Population characteristics of Dromiciops gliroides (Philippi, 1893), an endemic marsupial of the temperate forest of Patagonia». Mammalian Biology (en inglés) 73: 74-76.
- ↑ Echeverria, C.; Coomes, D; Salas, J; Rey-Benayas, J. M.; Lara, A; Newton, A (2006). «Rapid deforestation and fragmentation of Chilean temperate forest» (pdf). Biological Conservation (en inglés) 130 (4): 481-494. doi:10.1016/j.biocon.2006.01.017.
- ↑ Bustamante, R. O.; Simonetti, J. A. (2005). «Is Pinus radiata invading the vegetation in Central Chile? Demographic responses in a fragmented forest» (pdf). Biological Invasions (en inglés) 7: 243-249.
- ↑ Echeverria, C.; Lara, A; Rey-Benayas (2006). «Impact of forest fragmentation on species composition and forest structure in the temperate landscape of southern Chile». Global Ecology and Biogeography (en inglés) 16 (4): 426-439. doi:10.1111/j.1466-8238.2007.00311.x.
- ↑ a b Fontúrbel, Franciasco E.; Jiménez, Jaime E. (2011). «Arquitectos ambientales y ecológicos: Pautas para la gestión ambiental del bosque templado lluvioso de Chile derivadas de la conservación del monito del monte (Dromiciops gliroides)». Revista Chilena de Historia Natural 84: 203-211.
- ↑ Rodríguez-Cabal, M. A.; Aizen, M. A.; Novaro, A. J. (2007). «Habitat fragmentation disrupts a plant-disperser mutualism in the temperate forest of South America». Biological Conservation (en inglés) 139 (1): 195-202. doi:10.1016/j.biocon.2007.06.014.
Bibliografía
- Brands, S.J. (comp.) 1989-2005. Systema Naturae 2000. The Taxonomicon. Universal Taxonomic Services, Ámsterdam, Holanda. Acceso: 4 de octubre de 2007.
- Grzimek, B., Schlager, N. y Olendorf, D. (2003), Grzimek's Animal Life Encyclopedia, Thomson Gale.Detroit.
- IUCN (2007). Red List of Threatened Species. Acceso: 6 de octubre de 2007.
- Jansa, S. (2003) Dromiciops gliroides(On-line) Animal Diversity Web. Acceso: 6 de octubre de 2007.
- Marshall, L.G. (1978) Dromciops australis en Mammalian Species. 99. American Society of Mamalogists. Species.-01-0001.pdf Documento on-line
- Wilson, D.E. & Reeder D.M. (editors). (2005). Mammal Species of the World. A Taxonomic and Geographic Reference (3rd ed), Johns Hopkins University Press. 1-800-537-5487.
Enlaces externos
- Wikimedia Commons alberga una categoría multimedia sobre Andresisrael/Zona de Pruebas 3.
- Wikispecies tiene un artículo sobre Andresisrael/Zona de Pruebas 3.
- Infonatura Acceso: 16 de enero de 2012.