Pineen
Pineen (C10H16) is een organische verbinding. Het is een monoterpeen, dat uit twee ringen bestaat.[1] Er zijn twee natuurlijke isomeren bekend van pineen: α-pineen en β-pineen. Het zijn twee belangrijke bestanddelen van dennenharsen. Ze komen ook voor in de harsen van vele andere planten, zowel coniferen als niet-conifere planten. Een voorbeeld van deze laatste groep is Artemisia tridentata. Beide isomeren worden door vele insecten gebruikt bij hun chemische communicatie. Pinenen zijn de belangrijkste bestanddelen van terpentijn.
| Pineen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
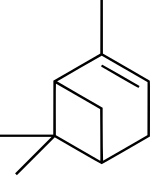
| ||||
α-pineen
| ||||
| Algemeen | ||||
| Molecuulformule | C10H16 | |||
| IUPAC-naam | (1S,5S)-2,6,6-trimethylbicyclo[3.1.1]hept-2-ene (1S,5S)-6,6-dimethyl- | |||
| Molmassa | 136,24 g/mol | |||
| CAS-nummer | 80-56-8 | |||
| Wikidata | Q2095629 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Dichtheid | 0,86 g/cm³ | |||
| Smeltpunt | −62 – −55 °C | |||
| Kookpunt | 155 – 156 °C | |||
| Oplosbaarheid in water | praktisch onoplosbaar in water g/L | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Otto Wallach is verantwoordelijk voor de naamgeving van terpeen en pineen. Hij was de eerste die een systematische studie deed naar pineen.
Planten
bewerkenAlfa-pineen is in de natuur de meest voorkomende terpenoïde.[2] en is sterk insectafstotend.[3]
Alfa-pineen komt voor in coniferenen in vele andere planten.[4] Pineen is het belangrijkste bestanddeel in de etherische olie van Sideritis spp..[5] en Salvia spp..[6] Cannabis bevat ook alfa-pineen.[4] Hars van de terpentijnboom (Pistacia terebinthus) is rijk aan pineen. Ook pijnboompitten bevatten pineen.[4]
Gebruik
bewerkenIn de chemische industrie geeft selectieve oxidatie van pineen met bepaalde katalysatoren vele grondstoffen voor de parfumindustrie, zoals kunstmatige geurstoffen. Een belangrijk oxidatieproduct is verbenon, samen met de pineen-oxiden, verbenol en verbenylhydroperoxide. [7]
Isomeren
bewerkenBiosynthese
bewerkenα-pineen en β-pineen worden beide gesynthetiseerd uit geranylpyrofosfaat, door ringvorming van linaloylpyrofosfaat gevolgd door het verlies van een proton van de koolstofequivalent.
- ↑ (en) J. Mann, R. S. Davidson, J. B. Hobbs, D. V. Banthorpe, J. B. Harborne, Natural Products, pp309–311, Addison Wesley Longman Ltd., Harlow, UK, 1994. ISBN 0-582-06009-5.
- ↑ (en) Noma Y, Asakawa Y (2010). Biotransformation of monoterpenoids by microorganisms, insects, and mammals. In: Baser KHC, Buchbauer G (eds). Handbook of Essential Oils: Science, Technology, and Applications. CRC Press: Boca Raton, FL, pp. 585–736.
- ↑ (en) (2010). Repellent activity of essential oils: a review. Bioresour Technol 101 (1): 372–378. PMID 19729299. DOI: 10.1016/j.biortech.2009.07.048.
- ↑ a b c (en) Russo, E. B (2011). Taming THC: potential cannabis synergy and phytocannabinoid-terpenoid entourage effects. British Journal of Pharmacology 163 (7): 1344–1364. PMID 21749363. PMC 3165946. DOI: 10.1111/j.1476-5381.2011.01238.x.
- ↑ Kose EO, Deniz IG, Sarikurkcu C, Aktas O, Yavuz M (2010). Chemical composition, antimicrobial and antioxidant activities of the essential oils of Sideritis erythrantha Boiss. and Heldr. (var. erythrantha and var. cedretorum P.H. Davis) endemic in Turkey. Food Chem Toxicol 48: 2960–2965.
- ↑ Ozek G, Demirci F, Ozek T, Tabanca N, Wedge DE, Khan SI et al. (2010). Gas chromatographic-mass spectrometric analysis of volatiles obtained by four different techniques from Salvia rosifolia Sm., and evaluation for biological activity. J Chromatog 1217: 741–748.
- ↑ U. Neuenschwander, Mechanism of the Aerobic Oxidation of α-Pinene , ChemSusChem, Band=3, Nummer=1, 2010, 75–84, DOI=10.1002/cssc.200900228