Aromatski spoj
Aromatski spojevi su oni spojevi (najčešće organski koji sadrže jedan ili više prstenova sa pi elektronima delokaliziranim oko njih. Za razliku od spojevaa koji pokazuju aromatičnost, alifatskom spoju nedostaje ova delokalizacija. Izraz "aromatski" dodijeljen je prije nego što je otkriven fizički mehanizam koji određuje aromatičnost i odnosio se jednostavno na činjenicu da mnogi takvi spojevi imaju slatkast ili ugodan miris. Međutim, nemaju svi aromatski spojevi slatkast miris, a nisu ni svi slatkog mirisa aromatični. Aromatski ugljikovodici ili areni su aromatski organski spojevi koji sadrže samo atome ugljika i vodika. Konfiguracija šest atoma ugljika u aromatskim spojevima naziva se "benzenski prsten", prema jednostavnom aromatskom spoju benzenu ili fenil grupi koja je dio većeg spoja.
Nisu svi aromatski spojevi na bazi benzena; aromatičnost se može manifestovati i u heteroarenima, koji slijede Hückelovo pravilo (za monociklične prstenove: kada je broj njegovih π elektrona jednak 4n + 2, gdje n = 0, 1, 2, 3, ...). U ovim spojevima, najmanje jedan atom ugljika zamijenjen je jednim od heteroatoma kisika, dušika ili sumpora. Primjeri nebenzenskih spojeva sa aromatskim svojstvima su furan, heterociklično jedinjenje s petočlanim prstenom, koji uključuje jedan atom kisika i piridin, heterociklični spoj sa šestočlanim prstenom, koji sadrži jedan atom dušika.[1]
Model benzenskog prstena
[uredi | uredi izvor]
Benzen, C6H6, najmanje je složeni aromatski ugljikovodik i prvi je kao takav imenovan. Prirodu njegovog vezanja prvi je prepoznao August Kekulé u 19. stoljeću. Svaki atom ugljika u heksagonskom ciklusu ima četiri elektrona za dijeljenje. Jedan odlazi na atom vodika, a jedan na svaki od dva susjedna ugljika. Ovo ostavlja jedan elektron da dijeli s jednim od dva susjedna atoma ugljika, stvarajući tako dvostruku vezu s jednim ugljikom, a ostavlja jednostruku vezu s drugim, zbog čega ga neki prikazi molekule benzena izgledaju kao šesterokut s izmjeničnim pojedinačnim i dvostrukim vezama.
Ostali prikazi strukture pokazuju šesterokut s krugom unutar njega, što ukazuje na to da šest elektrona pluta okolo u delokaliziranim molekulskim orbitalama veličine samog prstena. Ovo predstavlja ekvivalentnu prirodu šest veza ugljik-ugljik svih redoslijeda baza 1,5; ekvivalencija se objašnjava rezonantnim oblicima. Elektroni se vizualiziraju kako lebde iznad i ispod prstena, a elektromagnetna polja koja generiraju djeluju kako bi prsten ostao ravan.
- Ispoljavaju aromatičnost;
- Odnos ugljik-vodonik je visok;
- Izgaraju u jakom čađavom žutom plamenu zbog visokog odnosa ugljik-vodik;
- Podvrgnuti su reakciji elektrofilne supstitucije i nukleofilnim aromatskim supstitucijama .
Simbol kruga za aromatičnost uveli su Sir Robert Robinson i njegov student James Armit 1925.[2] a populariziran je počev od 1959. u udžbeniku organske hemije, Morrison & Boyd. Raspravlja se o pravilnoj upotrebi simbola: neke publikacije ga koriste za 'bilo koji' ciklični π-sistem, a druge samo za one π-sisteme koji poštuju Hückelovo pravilo. Jensen[3] tvrdi da bi, u skladu s Robinsonovim izvornim prijedlogom, upotreba simbola kruga trebala biti ograničena na monocikličke 6 π-elektronske sisteme. Na ovaj način, simbol kruga za šestocentralnu šestoelektronsku vezu može se uporediti sa simbolom Y za dvocentralnu elektronsku vezu.
Sinteza arena
[uredi | uredi izvor]Reakcija koja formira arenski spoj iz nezasićenog ili djelimično nezasićenog cikličnog prekursor naziva se jednostavno aromatizacija. Postoje mnoge laboratorijske metode za organsku sintezu arena iz nearenskih prekursora. Mnoge metode oslanjaju se na reakcije cikloaddicija. Alkimska trimerizacija opisuje [2 + 2 + 2] ciklizaciju tri alkina, u Dötzovoj reakciji reaktivni sastojci su alkin, ugljik-monoksid i hromni karbenaki kompleks. Diels-Alderova reakcija s alkinima sa pironom ili ciklopentadienonom, sa izbacivanjem ugljik-dioksida ili ugljik-monoksida takođe formira arenske spojeve. U Bergmanovoj ciklizaciji reaktanti su enin plus donor vodika.
Sljedeći skup metoda je aromatizacija cikloheksana i drugih alifatskih prstenova: reagensi su katalizatori koji se koriste u hidrogenizaciji poput platine, paladija i nikla (reverzno hidrogeniranje), kinona i elemenata sumpora i selena.
Reakcije
[uredi | uredi izvor]Aromaski prstenasti sistemi učestvuju u mnogim organskim reakcijama.
Aromatska supstitucija
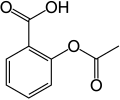
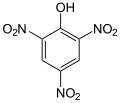
[uredi | uredi izvor]U aromatskoj supstituciji jedan supstituent na arenom prstenu, obično vodik, zamijenjuje se drugim supstituentom. Dvije glavne vrste su elektrofilna aromatska supstitucija, kada je aktivni reagens elektrofil i nukleofilna aromatska supstitucija, kada je reagens nukleofil. U radikalno-nukleofilnoj aromatskoj supstituciji aktivni reagens je radikal. Primjer elektrofilne aromatske supstitucije je nitriranje salicilne kiseline:[4]
Reakcije sprezanja
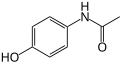
[uredi | uredi izvor]U reakcijama sprezanja, metal katalizira spregu između dva formalna radikalna fragmenta. Uobičajene reakcije sprezanja s arenima rezultiraju stvaranjem novih veza ugljik-ugljik, npr. Alkilareni, vinil areni, biralili, nova veza ugljik-dušik (anilini) ili novi veza ugljik-kisik (ariloksi spojevi). Primjer je direktna arilacija perfluorobenzena[5]
Hidrogenacija
[uredi | uredi izvor]Hidrogenacija arena stvara zasićene prstenove. Spoj 1-naftol se u potpunosti redukuje u smešu dekalinol izomera.[6]
Spoj resorcinol, hidrogenizzran sa Raneyevim niklom u prisustvu vodenog rastvora natrij-hidroksida formira enolat koji se alkilira sa metil-jodidom u 2-metil-1, 3-cikloheksandion:[7]
Cikloadicije
[uredi | uredi izvor]Cikloadicijske reakcije nisu česte. Neobična termalna Diels-Alderova reaktivnost arena može se naći u Wagner-Jaureggovoj reakciji. Ostale reakcije fotohemijske cikloadicije sa alkenima se javljaju putem ekscimera.
Dearomatizacija
[uredi | uredi izvor]U reakciji dearomatizacije aromatičnost reaktanta trajno se gubi.
Benzen i njegovi derivati
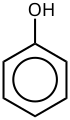
[uredi | uredi izvor]Derivati benzena imaju od jednog do šest supstituenata vezanih za centralno jezgro benzena. Primjeri benzenskih spojeva sa samo jednim supstituentom su fenol, koji nosi hidroksil grupu i toluen sa metil grupom. Kada je na prstenu prisutno više supstituenata, njihov prostorni odnos postaje važan za koji su osmišljeni obrasci supstitucije arena orto, meta i para. Naprimjer, postoje tri izomera za krezol, jer metilna grupa i hidroksilna grupa mogu biti postavljene jedna pored druge (orto), jedan položaj uklonjen jedan od drugog (meta) ili dva međusobno uklonjena položaja (para). Ksilenol, pored hidroksilne grupe, ima i dvije metilne grupe, a za ovu strukturu postoji 6 izomera.
- Predstavnici arenskih spojeva
Arenski prsten ima sposobnost stabilizacije naboja. To se vidi, naprimjer, u fenolu (C6H5–OH), koji je kiselina u hidroksilu (OH), jer se naboj na ovom kisiku (alkoksid–O−) djelimice delokalizir u benzenski prsten.
Ostali monociklični aromatskii ugljikovodici
[uredi | uredi izvor]Ostali monociklični aromatski ugljovodonici uključuju ciklotetradekaheptaen ili ciklooktadekanonaen.
Policiklični aromatskii ugljikovodici
[uredi | uredi izvor]
Policiklični aromatični ugljikovodici (PAH) su aromatični ugljikovodici koji se sastoje od sraslih aromatskih prstenova i ne sadrže heteroatome ili nose supstituent.[8] Najjednostavniji primjer PAH-a j naftalen. PAH se javljaju u ležištima naftanafre, uglja i katrana, a proizvode se kao nusprodukti sagorijevanja goriva (bilo fosilnog ili biomase). Kao zagađivači, zabrinjavaju jer su neki spojevi identificirani kao kancerogeni mutageni i teratogeni. PAH se također nalaze u kuhanoj hrani. Studije su pokazale da se visoki nivoi PAH-a nalaze, naprimjer, u mesu kuhanom na visokim temperaturama, kao što je pečenje na roštilju, te u dimljenoj ribi.[9][10][11]
Također se nalaze u međuzvjezdanom mediju, u kometama i meteoritoma i predstavljaju kandidatske molekule koje djeluju kao osnova za najranije oblike života. U grafenu motiv PAH proširen je na velike 2D listove.
Također pogledajte
[uredi | uredi izvor]- Aromatski supstituenti: aril, ariloksi i arenediil
- Asfalten
- Hidrodealkilacija
- Jednostavni aromatski prsten
- Rodij-platina oksid
- Aromatičnost
Reference
[uredi | uredi izvor]- ^ Enciklopedija HighBeam: aromatični spoj.
- ^ Armit, James Wilkins; Robinson, Robert (1925). "Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". J. Chem. Soc. Trans. 127: 1604–1618.
- ^ Jensen, William B. (april 2009). "The circle symbol for aromaticity" (PDF). J. Chem. Educ. 86 (4): 423–424. Bibcode:2009JChEd..86..423J. doi:10.1021/ed086p423.
- ^ Webb, K.; Seneviratne, V. (1995). "A mild oxidation of aromatic amines". Tetrahedron Letters. 36 (14): 2377–2378. doi:10.1016/0040-4039(95)00281-G.
- ^ Lafrance, M.; Rowley, C.; Woo, T.; Fagnou, K. (2006). "Catalytic intermolecular direct arylation of perfluorobenzenes". Journal of the American Chemical Society. 128 (27): 8754–8756. doi:10.1021/ja062509l. PMID 16819868.
- ^ Org-Synth|title=1-Naphthol |last1=Meyers |first1=A. I. |last2=Beverung |first2=W. N. |last3=Gault|first3=R. |collvol=6 |collvolpage=371 |volume=51 |page=103 |date=1971 |prep=CV6P0371}}
- ^ Org-Synth|title=Ethyl Indole-2-carboxylate |last1=Noland |first1=Wayland E. |last2=Baude |first2=Frederic J. |collvol=5 |collvolpage=743 |volume=41 |page=56 |date=1961 |prep=CV5P0567}}
- ^ Fetzer, J. C. (2000). "The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons". Polycyclic Aromatic Compounds. New York: Wiley. 27 (2): 143. doi:10.1080/10406630701268255. ISBN 0-471-36354-5.
- ^ "Polycyclic Aromatic Hydrocarbons – Occurrence in foods, dietary exposure and health effects" (PDF). European Commission, Scientific Committee on Food. 4. 12. 2002.
- ^ Larsson, B. K.; Sahlberg, GP; Eriksson, AT; Busk, LA (1983). "Polycyclic aromatic hydrocarbons in grilled food". J. Agric. Food Chem. 31 (4): 867–873. doi:10.1021/jf00118a049. PMID 6352775.
- ^ "Polycyclic Aromatic Hydrocarbons (PAHs)". Agency for Toxic Substances and Disease Registry. 1996. Arhivirano s originala, 8. 2. 2021. Pristupljeno 29. 1. 2021.