Borazin
| Borazin | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,3,5,2,4,6-triazatriborinan |
| Ostatní názvy | borazol |
| Sumární vzorec | B3H6N3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 6569-58-3 |
| PubChem | 138768 |
| SMILES | [BH-]1-[NH+]=[BH-]-[NH+]=[BH-]-[NH+]=1 |
| InChI | InChI=1S/B3H6N3/c1-4-2-6-3-5-1/h1-6H |
| Vlastnosti | |
| Molární hmotnost | 80,50 g/mol |
| Teplota tání | −58 °C (215 K) |
| Teplota varu | 53 °C (326 K) |
| Hustota | 0,81 g/cm3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Borazin, také nazývaný borazol, je anorganická sloučenina se vzorcem B3H6N3. V její molekule se střídají tři BH a tři NH jednotky. Sloučenina je izoelektronická a izostrukturní s benzenem a tak bývá někdy nazývána „anorganický benzen“. Podobně jako u benzenu jde o bezbarvou kapalinu[2] s aromatickým zápachem.
Příprava
[editovat | editovat zdroj]Borazin popsali roku 1926 chemici Alfred Stock a Erich Pohland jako produkt reakce diboranu s amoniakem.[3]
Borazin lze získat reakcí diboranu a amoniaku v molárním poměru 1:2 při 250–300 °C; výtěžnost reakce je 50 %:
- 3 B2H6 + 6 NH3 → 2 B3H6N3 + 12 H2
Jiný, účinnější, postup spočívá v reakci tetrahydridoboritanu sodného se síranem amonným:[4]
- 6 NaBH4 + 3 (NH4)2SO4 → 2 B3N3H6 + 3 Na2SO4 + 18 H2
Borazin je také možné získat dvoukrokovým postupem, ve kterém je nejprve chlorid boritý přeměněn na trichlorborazin:
- 3 BCl3 + 3 NH4Cl → Cl3B3H3N3 + 9 HCl
a vazby B-Cl se následně mění na vazby B-H:
- 2 Cl3B3H3N3 + 6 NaBH4 → 2 B3H6N3 + 3 B2H6 + 6 NaCl
Struktura
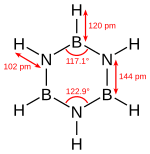
[editovat | editovat zdroj]Borazin je izoelektronický s benzenem a má podobný systém vazeb, a tak bývá někdy nazýván „anorganický benzen“. Toto přirovnání však není zcela přesné, protože bor a dusík mají rozdílné elektronegativity. Pomocí rentgenové krystalografie bylo zjištěno, že délky všech vazeb v borazinovém cyklu jsou 142,9 pm, tedy podobné jako u benzenu.[5]
Borazinový cyklus nevytváří však pravidelný šestiúhelník; vazebné úhly jsou 117,1° na atomech boru a 122,9° na dusících, v důsledku čehož má molekula odlišnou symetrii.
Elektronegativita boru na Paulingově stupnici je 2,04, zatímco u dusíku má hodnotu 3,04, což má za následek snížení elektronové hustoty na atomech boru a volný elektronový pár na dusíku tak vytváří různé mezomerní struktury.

Bor se chová jako Lewisova kyselina a dusík jako Lewisova zásada.
Aromaticita
[editovat | editovat zdroj]Vzhledem k jeho podobnosti s benzenem bylo u borazinu provedeno několik výpočetních a experimentálních analýz ohledně aromaticity. Počet pí elektronů v molekule borazinu odpovídá pravidlu 4n + 2 a délky všech vazeb B-N jsou stejné, což naznačuje, že by mělo jít o aromatickou sloučeninu. Rozdíly v elektronegativitě mezi borem a dusíkem však způsobují nerovnoměrné rozdělení náboje, které vede k více iontové povaze vazeb a delokalizace elektronů tak je slabší. Borazin je se standardní slučovací entalpií ΔHf −531 kJ/mol tepelně značně stabilní.
Přirozené vazebné orbitaly
[editovat | editovat zdroj]Analýzou přirozených vazebných orbitalů bylo zjištěno, že borazin je jen slabě aromatický.[6]
V modelu přirozených vazebných orbitalů jsou vazby B-N v cyklu mírně odchýlené od spojnic atomových jader a B a N mají rozdílné náboje. Na základě analýzy přirozeného chemického stínění byla získána další data podporující aromaticitu vazeb B-N. Výpočty založenými na přirozených vazebných orbitalech se ukázalo, že tyto vazby π vytvářejí slabý kruhový proud, který naznačuje určitou míru delokalizace.
Elektronová lokalizační funkce (ELF)
[editovat | editovat zdroj]Topologickou analýzou prostřednictvím elektronové lokalizační funkce (ELF) lze zjistit, že borazin může být popsán jako π aromatická sloučenina. Vazby v borazinu jsou ovšem méně delokalizované než v benzenu.[7]
Reaktivita
[editovat | editovat zdroj]Hydrolýza
[editovat | editovat zdroj]Borazin se snadno hydrolyzuje za vzniku kyseliny borité, amoniaku a vodíku.
Polymerizace
[editovat | editovat zdroj]Zahříváním borazinu na 70 °C se uvolňuje vodík a vzniká polyborazylen:
- n B3N3H6 → 1/n[B3N3H4]n

Reakce s halogenovodíky a halogeny
[editovat | editovat zdroj]S chlorovodíkem vytváří borazin adukt.
- B3N3H6 + 3 HCl → B3N3H9Cl3
- Adiční reakce borazinu s chlorovodíkem
- B3N3H9Cl3 + NaBH4 → (BH4N)3
- Redukce borazinu tetrahydridoboritanem sodným
K provedení adiční reakce s bromem není nutný katalyzátor. U borazinů probíhají nukleofilní ataky na atomy boru a elektrofilní na atomy dusíku.
Prekurzor keramických materiálů
[editovat | editovat zdroj]Nitrid boritý lze připravit zahříváním polyborazylenu na 1 000 °C.[4]
Boraziny se také používají na výrobu dalších keramických materiálů, například karbonitridů boru. Rovněž mohou sloužit jako prekurzory při přípravě tenkých vrstev a jednovrstevných povlaků hexagonálního nitridu boritého na povrchu katalyzátorů, jako jsou měď,[8] platina,[9] nikl,[10] železo[11] i další, pomocí chemické depozice z plynné fáze.
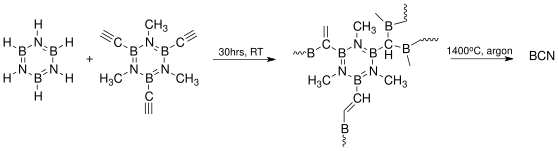
Polyborazyleny byly navrženy jako možné materiály pro uchovávání vodíku v palivových článcích.[12]
Společně s jinými sloučeninami typu B-N byly u smíšených amino-nitrovaných borazinů zjištěny výbušné vlastnosti podobné jako u CL-20.[13][14]
Podobné sloučeniny
[editovat | editovat zdroj]C2H2B2N2 je šestičlenný heterocyklus obsahující dva atomy uhlíku, dva dusíky a dva atomy boru ve dvojicích naproti sobě.[15][16]
1,2-Dihydro-1,2-azaborin (C4BNH6) je šestičlenný heterocyklus se čtyřmi atomy uhlíku, jedním dusíkem a jedním borem.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Borazine na anglické Wikipedii.
- ↑ a b Borazine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Duward Shriver; Peter Atkins. Inorganic Chemistry. New York: W. H. Freeman and Company, 2010. ISBN 978-1429218207. S. 328.
- ↑ Alfred Stock; Erich Pohland. Borwasserstoffe, VIII. Zur Kenntnis des B2H6 und des B5H11. Chemische Berichte. 1926, s. 2210–2215. DOI 10.1002/cber.19260590906.
- ↑ a b Thomas Wideman; Paul J. Fazen; Anne T. Lynch; Kai Su; Edward E. Remsen; Larry G. Sneddon. Borazine, Polyborazylene, β‐Vinylborazine, and Poly(β‐Vinylborazine). Inorganic Syntheses. 1998. DOI 10.1002/9780470132630.ch39.
- ↑ R. Boese; A. H. Maulitz; P. Stellberg. Solid-State Borazine: Does it Deserve to be Entitled "Inorganic Benzene"?. Chemische Berichte. 1994, s. 1887–1889. DOI 10.1002/cber.19941271011.
- ↑ W. Shen; M. Li; F. Li; S. Wang. Theoretical study of borazine and its derivatives. Inorganica Chimica Acta. 2007, s. 619–624. DOI 10.1016/j.ica.2006.08.028.
- ↑ J. C. Santos; W. Tiznado; R. Contreras; P. Fuentealba. Sigma-pi separation of the electron localization function and aromaticity. The Journal of Chemical Physics. 2004, s. 1670–1673. DOI 10.1063/1.1635799. PMID 15268298. Bibcode 2004JChPh.120.1670S.
- ↑ In Situ Observations during Chemical Vapor Deposition of Hexagonal Boron Nitride on Polycrystalline Copper. Chemistry of Materials. 2014, s. 6380–6392. DOI 10.1021/cm502603n. PMID 25673919.
- ↑ G. Kim; A. R. Jang; H. Y. Jeong; Z. Lee; D. J. Kang; H. S. Shin. Growth of high-crystalline, single-layer hexagonal boron nitride on recyclable platinum foil. Nano Letters. 2013, s. 1834–1839. DOI 10.1021/nl400559s. PMID 23527543. Bibcode 2013NanoL..13.1834K.
- ↑ Shahana Chatterjee; Zhengtang Luo; Muharrem Acerce; Douglas M. Yates; A. T. Charlie Johnson; Larry G. Sneddon. Chemical Vapor Deposition of Boron Nitride Nanosheets on Metallic Substrates via Decaborane/Ammonia Reactions. Chemistry of Materials. 2011-10-25, s. 4414–4416. ISSN 0897-4756. DOI 10.1021/cm201955v.
- ↑ Nucleation control for large, single crystalline domains of monolayer hexagonal boron nitride via Si-doped Fe catalysts. Nano Letters. 2015, s. 1867–1875. DOI 10.1021/nl5046632. PMID 25664483. Bibcode 2015NanoL..15.1867C.
- ↑ Efficient regeneration of partially spent ammonia borane fuel. Angewandte Chemie. 2009, s. 6812–6816. DOI 10.1002/anie.200900680. PMID 19514023.
- ↑ E. C. Koch; T. M. Klapötke. Boron-Based High Explosives. Propellants, Explosives, Pyrotechnics. 2012, s. 335–344. DOI 10.1002/prep.201100157.
- ↑ Polymorphism, fluorescence, and optoelectronic properties of a borazine derivative. Chemistry. 2013, s. 7771–7779. Dostupné online. DOI 10.1002/chem.201204598.
- ↑ Ambrish Kumar Srivastava; Neeraj Misra. Introducing "carborazine" as a novel heterocyclic aromatic species. New Journal of Chemistry. 2015, s. 2483–2488. DOI 10.1039/c4nj02089h.
- ↑ D. Bonifazi; F. Fasano; M. M. Lorenzo-Garcia; D. Marinelli; H. Oubaha; J. Tasseroul. Boron-nitrogen doped carbon scaffolding: organic chemistry, self-assembly and materials applications of borazine and its derivatives. Chemical Communications. 2015, s. 15 222 – 15 236. DOI 10.1039/C5CC06611E. PMID 26411675.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Borazin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Borazin na Wikimedia Commons