Acrylamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
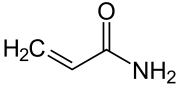
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Acrylamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5NO | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 71,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,13 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd (CMR)[5] | ||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||

Das Acrylamid gehört zur chemischen Gruppe der Amide. In reiner Form ist es ein weißes, geruchloses, kristallines Pulver, das in Wasser, Ethanol und Ether löslich ist.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Die gezielte chemische Synthese von Acrylamid erfolgt durch Hydrolyse von Acrylnitril mit Kupferkatalysatoren oder durch enzymatische Hydrolyse:

Die Entstehung durch die Maillard-Reaktion bei starker Erhitzung stärkehaltiger Lebensmittel besitzt keine präparative Bedeutung.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Polymerisationswärme beträgt −79,4 kJ·mol−1 bzw. −1117 kJ·kg−1.[8]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Acrylamid wird zur Herstellung von Polymeren und Farbstoffen verwendet. Unvernetzte (Co)Polymere von Acrylamid sind meist wasserlöslich und werden als Stabilisatoren oder Flockungsmittel in vielen Anwendungen, beispielsweise in der Abwasseraufbereitung oder der Papierherstellung verwendet. Quervernetzte Polyacrylamide sind nicht löslich und quellen in Wasser nur noch auf; sie werden als Trägermaterial bei der Gelelektrophorese (SDS-PAGE) sowie als Verdickungsmittel in Kosmetika genutzt. Quervernetzte Copolymere von Acrylamid und Acrylsäure werden als Superabsorber eingesetzt, z. B. in Windeln.
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Details zum Einfluss von Acrylamid auf den menschlichen Stoffwechsel sind noch weitgehend unerforscht. Aus Tierversuchen sind zwei Wirkungsweisen bekannt: Acrylamid greift zum einen direkt die DNA an, zum anderen wird es von Leberenzymen in Glycidamid umgesetzt. Diesem reaktiven Stoff wird eine starke genotoxische Wirkung zugeschrieben. Acrylamid wie auch Glycidamid bilden Verbindungen mit Aminosäuren und Nukleinbasen und können so die Struktur und Funktion beispielsweise der DNA und des Hämoglobin verändern. Im Tierversuch wurde die Weitergabe der erbgutverändernden Wirkung auch an Tochtergenerationen beobachtet.
Die Einordnung als krebserregend basiert ausschließlich auf Untersuchungen mit hohen Acrylamiddosen an Ratten und Mäusen. Beim Menschen fehlen trotz langjähriger Suche klare epidemiologische Ergebnisse für ein erhöhtes Krebsrisiko. Im Gegenteil: Eine Studie von 2003 fand kein erhöhtes Krebsrisiko („no measurable impact“), das Darmkrebsrisiko nahm mit zunehmenden Acrylamidgehalten in der Nahrung sogar ab.[9] Hierbei ist zudem zu beachten, dass nur in die Blutbahn gelangtes Acrylamid relevant ist; Studien legen nahe, dass die Aufnahme von Acrylamid mit der Nahrung kaum zu einem erhöhten Blutspiegel führt.[10] Entsprechend wird Acrylamid als Karzinogen, Kategorie 1B (nachweislich karzinogen im Tierversuch, wahrscheinlich karzinogen beim Menschen) eingestuft.
Acrylamid in Lebensmitteln
[Bearbeiten | Quelltext bearbeiten]Acrylamid wurde wiederholt seit Juni 2000 zunächst von schwedischen Wissenschaftlern in verschiedenen Lebensmitteln (insbesondere in stärkehaltigen und stark erhitzten Lebensmitteln wie Pommes frites) nachgewiesen.[11][12][13]
Bei einer ab Herbst 2003 durchgeführten Studie der Medizinischen Hochschule Hannover wurde bei über 80 % der 395 Teilnehmer Acrylamid im Blut nachgewiesen. Bei Personen, die mehrmals pro Woche Pommes frites oder Kartoffelchips essen, wurde ein – gegenüber den anderen Studienteilnehmern – leicht und „aus wissenschaftlicher Sicht nicht signifikant“ erhöhter Acrylamidspiegel im Blut festgestellt. Raucher waren mit durchschnittlich 1,5 μg pro Liter Blut gut dreimal höher belastet als Nichtraucher (0,4 μg pro Liter Blut). Aus den Ergebnissen wurde gefolgert, dass nicht nur die Ernährung, sondern „möglicherweise auch körpereigene Abbauprozesse von Proteinen dazu beitragen, dass Acrylamid in unseren Blutkreislauf gelangt“.[10]
Entstehung in Lebensmitteln
[Bearbeiten | Quelltext bearbeiten]
Es entsteht in der Maillard-Reaktion bei Überhitzung von Stärke, insbesondere beim Backen, Braten, Rösten, Grillen und Frittieren. Dementsprechend nimmt der Mensch Acrylamid in mehr oder weniger geringen Dosen mit seiner Nahrung auf, seitdem er dazu übergegangen ist, seine Nahrung zu erhitzen. Der wichtigste Ausgangsstoff für Acrylamid in Lebensmitteln ist die Aminosäure Asparagin, die vor allem in Kartoffeln und in Getreide vorkommt. Gefördert wird die Acrylamidbildung durch Zucker wie Fructose und Glucose.[14] Weitere Entstehungsmöglichkeiten sind die Oxidation von Acrolein und die Fragmentierung von Proteinen und Peptiden.[15]
Besonders viel Acrylamid entsteht, wenn kartoffel- und getreidehaltige Lebensmittel trocken über 180 °C erhitzt werden. Eine nachweisbare Acrylamidbildung beginnt bereits bei 120 °C und steigt bei den gelegentlich bei Brat- und Backvorgängen erreichten Temperaturen von 170–180 °C sprunghaft an. Die äußeren trockenen Schichten oder auch Brotkrusten enthalten auch deutlich höhere Mengen Acrylamid als die nicht gebräunten inneren Bereiche. Ähnliches gilt für geröstete Lebensmittel wie Kaffee, Knäckebrot und Zwieback. In Kartoffeln kann bei Lagerung unter 4 °C der Fructosegehalt stark ansteigen, was beim späteren Braten und Frittieren zu höherer Acrylamidbildung führt.
Eine gänzlich acrylamidfreie Ernährung ohne Verzicht auf trocken erhitzte Lebensmittel ist derzeit technisch nicht möglich. Ein Grenzwert wurde, wegen fehlender Erkenntnisse zur gesundheitlichen Wirkung bei Menschen, für Lebensmittel nicht festgesetzt. Es werden jedoch jährlich Signalwerte durch das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit ermittelt, auf deren Grundlage die zuständigen Behörden der Bundesländer mit Herstellern besonders hoch belasteter Produkte in einen Dialog zur Minimierung der Werte treten. Beispielsweise bei Kartoffelchips beträgt dieser Signalwert 1.000 Mikrogramm pro Kilogramm.
Es ist möglich, die Acrylamidbildung durch eine Änderung von Rezepturen und Herstellungsverfahren zu reduzieren. In vielen Fällen kann bereits eine Absenkung der Höchsttemperatur beim Backen um 10–20 °C oder der Austausch von oder Verzicht auf einzelne Zutaten die Bildung von Acrylamid verringern. So hat das Bayerische Landesamt für Gesundheit und Lebensmittelsicherheit einen hohen Anteil an Mandeln und vor allem das Backtriebmittel Ammoniumhydrogencarbonat (früher: Ammoniumbicarbonat, auch: Hirschhornsalz) als Hauptquelle bei Lebkuchen ausgemacht. Nach Weglassen der Mandeln und Verwendung von Natron (Natriumhydrogencarbonat, früher: Natriumbicarbonat) in der Kombination mit Dinatriumdihydrogendiphosphat und Dicalciumphosphat als Triebmittel fiel der Acrylamidgehalt auf ein Zehntel des vorherigen Werts. Allerdings können sich diese Maßnahmen (zum Teil in erheblichem Maße) nachteilig auf die Qualität, insbesondere Aroma und Konsistenz, der Lebensmittel auswirken.
Neben diesen Maßnahmen zur Reduzierung der Acrylamidbildung (optimierte Rohstoffauswahl und -behandlung sowie Veränderung vorhandener Verfahrensschritte) ist auch die Entwicklung neuartiger Prozesstechniken denkbar, beispielsweise der Einsatz der Vakuumfrittiertechnik bei der Kartoffelchipsproduktion.[16]
Minimierung von Acrylamid bei Kartoffelchips und anderen Lebensmitteln
[Bearbeiten | Quelltext bearbeiten]Die deutsche Kartoffelchips-Industrie hat seit dem ersten Bekanntwerden der Acrylamidproblematik im Sinne des vorbeugenden gesundheitlichen Verbraucherschutzes gehandelt und ein Monitoring der Acrylamid-Gehalte begonnen. Zu diesem Zweck wurden im verbandseigenen Institut LCI für die Mitgliedsfirmen des Bundesverbandes der deutschen Süßwarenindustrie (BDSI) systematische Analysen durchgeführt.[17]
Das LCI veröffentlicht die wöchentlichen Acrylamidmittelwerte der in Deutschland produzierenden Kartoffelchipshersteller in Form einer sog. Wochenmittelwerte-Grafik, an der die Wirksamkeit der seit April 2002 durchgeführten Minimierungsmaßnahmen erkannt werden kann. In dieser Grafik sind die Wochenmittelwerte beginnend im April 2002 bis Ende März 2017 und basierend auf fast 33.000 vom LCI für die Kartoffelchips herstellenden Mitgliedsfirmen des BDSI systematisch durchgeführten Acrylamid-Analysen eingetragen. Auch in anderen Lebensmittelgruppen, wie z. B. den Feinen Backwaren konnten insbesondere durch Rezepturumstellungen sowie den gezielten Einsatz des Enzyms Asparaginase Acrylamidminimierungen erreicht werden.[18]
Lebensmittelhersteller sowie Restaurants und Imbissbetriebe müssen seit dem 11. April 2018 die in der Verordnung (EU) 2017/2158[19] festgelegten Verfahren zur Eindämmung von Acrylamid in bestimmten Lebensmitteln anwenden.[20] Diese Verfahren beziehen sich auf die Auswahl der Rohstoffe und deren Lagerung, die Zubereitung der Lebensmittel und durch den Hersteller einzurichtende Kontrollverfahren. Zudem wird eine entsprechende Kennzeichnung für diese Lebensmittel, welche durch den Endverbraucher zubereitet werden, vorgesehen sowie ein sehr detailliertes Verfahren der Probennahme und -aufbereitung. Für kleine Betriebe, welche zugleich Einzelhandel betreiben (z. B. Bäckereien, Imbissbetriebe) gelten vereinfachte Auflagen. Die Verordnung enthält keinerlei Sanktionierungsvorschrift.[19] Es liegt also im Ermessen der einzelnen EU-Staaten die Einhaltung der Vorschriften mit Strafvorschriften zu bewehren.
Acrylamid in Kosmetika
[Bearbeiten | Quelltext bearbeiten]Acrylamid kann als Verunreinigung von Polyacrylamid in Kosmetika auftreten, aber auch als Verunreinigung von z. B. Polyquaternium-7, das in Haarpflegeprodukten und Haarwaschmitteln verwendet wird.[21]
Absorption und Metabolisierung im Körper
[Bearbeiten | Quelltext bearbeiten]Acrylamid wird bei der Verdauung im Magen-Darm-Trakt absorbiert und verteilt sich in die meisten Gewebe. Katalysiert durch Cytochrom P450 2E1 kann das Epoxid Glycidamid entstehen. Acrylamid und Glycidamid können Addukte mit der DNA sowie Hämoglobin und anderen Proteinen formen. Die Addukte mit Hämoglobin werden als Biomarker verwendet. Beide Stoffe können auch Mercaptursäuren bilden; diese wird mit dem Urin ausgeschieden. Glycidamid kann in der Leber zu Glyciramid verstoffwechselt werden; dieses wird mit dem Urin ausgeschieden.[22]
Gefährlichkeitsmerkmale
[Bearbeiten | Quelltext bearbeiten]Orale Toxizität
[Bearbeiten | Quelltext bearbeiten]Acrylamid besitzt eine merkliche akute orale Toxizität. Beim gewerblichen Umgang mit der Substanz sind dementsprechende Vorsichtsmaßnahmen zu beachten. Für den Transport gelten ähnliche Vorschriften, dabei wird der Stoff durch die UN-Nummer 2074 identifiziert.
Genotoxizität und Krebsrisiko
[Bearbeiten | Quelltext bearbeiten]Acrylamid und sein im Körper gebildetes Produkt Glycidamid bilden Addukte mit den DNA-Basen Adenin, Guanin und Cytosin. Das Epoxid Glycidamid ist dabei reaktiver als Acrylamid.[23] In Zellkulturen ist ein Zusammenhang zwischen längerer Exposition mit Acrylamid und schweren DNA-Schäden wie Genmutationen oder DNA-Brüchen bekannt.[24]
Obwohl die Internationale Agentur für Krebsforschung 1994 festhielt, dass keine hinreichenden Belege für menschliche Karzinogenität von Acrylamid vorhanden seien, wurde Acrylamid aufgrund der Laboruntersuchungen an Ratten und Mäusen als wahrscheinlich krebserzeugend eingestuft.[25]
Die WHO gibt als allgemeine Empfehlung zu Acrylamid folgende Erklärung ab: „Es gibt nicht genügend Anhaltspunkte über den Acrylamidgehalt in verschiedenen Lebensmitteln um eine allgemeine Empfehlung für die Vermeidung irgendeines Nahrungsmittels abgeben zu können.“[26]
Das Bundesinstitut für Risikobewertung hält fest,
„a) aufgrund dieser uneinheitlichen Ergebnisse der in die Bewertung eingeschlossenen Studien kann weder angenommen noch ausgeschlossen werden, dass es kausale Zusammenhänge zwischen der Acrylamidaufnahme und einer Krebsentstehung beim Menschen gibt.
b) Festzustellen ist in diesem Kontext, dass epidemiologisch bisher kein eindeutiger Zusammenhang zwischen Krebserkrankungen und der Acrylamid-Exposition nachgewiesen werden konnte. Möglicherweise ist das Risiko einer Krebsentstehung – sofern beim Menschen vorhanden – bei der gegebenen Exposition praktisch kaum nachweisbar.“
Die Europäische Behörde für Lebensmittelsicherheit (EFSA) veröffentlichte im Juni 2015 ein wissenschaftliches Gutachten zu Acrylamid in Lebensmitteln. Demnach liefern Tierstudien Beweise für eine genotoxische und krebserregende Wirkung. Hinweise aus Humanstudien, dass die gegenwärtige Exposition Krebs verursacht, seien derzeit noch begrenzt und nicht schlüssig. Da Acrylamid sich in einer Vielzahl alltäglicher Lebensmittel findet, betrifft dieses Gesundheitsproblem alle Verbraucher, wobei Kinder (bezogen auf ihr Körpergewicht) die exponierteste Altersgruppe sind. Die Lebensmittel mit dem größten Beitrag zur Acrylamidexposition sind frittierte Kartoffelerzeugnisse, Kaffee, Kekse, Cracker, Knäcke- und Toastbrot.[27]
Eine 2003 im British Journal of Cancer veröffentlichte Studie kam zu dem Schluss, dass Acrylamid in der Nahrung das Krebsrisiko beim Menschen nicht signifikant erhöht und dass das Darmkrebsrisiko bei Menschen, die Acrylamid-haltige Lebensmittel zu sich nehmen sogar geringfügig geringer ist.[28]
Im Jahr 2015 wurde am Mario Negri Institute for Pharmacological Research in Mailand eine Meta-Studie zum Thema Acrylamid und Krebsgefahr veröffentlicht, die 32 Studien zum Thema auswertete. Das Ergebnis dieser Meta-Studie lautet: „Die systematische Überprüfung und Meta-Analyse epidemiologischer Studien zeigt, dass Acrylamid nicht mit dem Risiko der häufigsten Krebserkrankungen zusammenhängt.“[29]
Ebenfalls keine Assoziation mit Krebsrisiken wurde in Meta-Analysen gefunden für Nierenzellkarzinome[30] und Pankreaskarzinom[31]. Während bei Frauen insgesamt auch gynäkologische Tumoren nicht mit der Acrylamidaufnahme in Verbindung stehen,[32] besteht eine Risikosteigerung für prämenopausale Frauen und Nichtraucherinnen für Brustkrebs, Endometriumkarzinom und Eierstockskrebs.[33][34]
Neurotoxizität
[Bearbeiten | Quelltext bearbeiten]Arbeiter, die hohen Acrylamid-Dosen ausgesetzt waren, zeigen neurologische Symptome wie Kopfschmerzen oder Beinkrämpfe. Es kann mehrere Wochen dauern, bis die Symptome auftreten. Weitere Manifestationen sind Muskelschwäche, sensorische Beeinträchtigungen wie Gleichgewichtsverlust und Sehstörungen wie Lichtempfindlichkeit. Andere bekannte Symptome sind Schwindel, undeutliche Sprache und Lethargie. Die Symptome entwickeln sich aufgrund einer Überaktivierung von Acetylcholinesterase, Dopaminerschöpfung und der Degeneration distaler Axone.
Acrylamid beeinflusst den circadianen Rhythmus negativ.[35] Eine 2017 veröffentlichte Studie entdeckte einen möglichen Zusammenhang zwischen Aufnahme von Acrylamid durch die Nahrung und leichtem kognitiven Verfall bei nicht rauchenden älteren chinesischen Männern.[36]
Reproduktionstoxizität
[Bearbeiten | Quelltext bearbeiten]Im Tierversuch ist eine starke Beeinträchtigung von Spermienanzahl und -beweglichkeit durch Acrylamidexposition bei Mäusen und Ratten nachgewiesen. Acrylamid beeinflusst möglicherweise Kinesine im Schwanz des Spermiums negativ.[37]
Entwicklungstoxizität
[Bearbeiten | Quelltext bearbeiten]Acrylamidexposition bewirkt schwere morphologische Schäden bei Zebrafischembryos.[38]
Eine norwegische Langzeitstudie zeigt, dass eine hohe Acrylamidaufnahme durch die Nahrung während der Schwangerschaft eine geringere Kindsgröße bei der Geburt und einen erhöhten BMI während der Kindheit verursacht.[39]
Acrylamidrechner
[Bearbeiten | Quelltext bearbeiten]Eine annähernde Berechnung der individuell aufgenommenen Dosis bei Eingabe der Essgewohnheiten ermöglicht das BfR-Acrylamidrechenprogramm des Bundesinstituts für Risikobewertung.[40]
Arbeitsschutz
[Bearbeiten | Quelltext bearbeiten]Laut der Technischen Regel für Gefahrstoffe (TRGS) 910 beträgt die Akzeptanzkonzentration (AK) von Acrylamid 0,07 mg/m³, die Toleranzkonzentration (TK) liegt bei 0,15 mg/m³.
Bei Überschreitung einer Arbeitsplatzkonzentration von 0,15 mg/m³ sind die gleichen Maßnahmen gemäß Gefahrstoffverordnung zu ergreifen wie bei Überschreitung eines Arbeitsplatzgrenzwerts. Bei Arbeitsplatzkonzentrationen zwischen 0,07 mg/m³ und 0,15 mg/m³ sind die Maßnahmen zu ergreifen, die in der TRGS 910 für den Bereich mittleren Risikos (Maßnahmenbereich) genannt sind. Die individuelle Belastung wird durch Biomonitoring ermittelt. Liegt die innere Belastung höher, als es der Stoffkonzentration in der Arbeitsplatzluft entspricht, weist dies auf einen zusätzlichen dermalen oder oralen Aufnahmeweg hin.
In der Expositionsdatenbank MEGA sind insgesamt 75 Arbeitsplatzmesswerte mit Expositionsbezug dokumentiert. 98,7 % zeigen ein niedriges Risiko (≤ 0,07 mg/m³). Bei 1,3 % der Messwerte ist keine Zuordnung zu den Risikobereichen möglich (Messwert < Bestimmungsgrenze > AK). Die meisten Messwerte stammen aus der chemischen Industrie (24) und der Glasindustrie (23). Labore waren bei den am häufigsten untersuchten Arbeitsbereichen (22).[41]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Scientific Opinion on acrylamide in food. In: EFSA Journal. 13, 2015, S. 4104, doi:10.2903/j.efsa.2015.4104.
- Anonymus: Acrylamid in Lebensmitteln – ernstes Problem oder überschätzte Gefahr? In: Umweltmedizin in Forschung und Praxis. 5/7/2002, S. 288.
- Thomas Schettgen, Hans Drexler, Jürgen Angerer: Acrylamid in der deutschen Allgemeinbevölkerung – eine Abschätzung der täglichen Aufnahme. In: Umweltmedizin in Forschung und Praxis. 6/7/2002, S. 331–336.
- S. Madle, L. Broschinski, O. Mosbach-Schulz, G. Schöning, A. Schulte: Zur aktuellen Risikobewertung von Acrylamid in Lebensmitteln. In: Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 46/2003, S. 405–415.
- Chip companies settle acrylamide lawsuit in California
- Omas Plätzchen sind die besten! Warnungen vor hohen Backtemperaturen sind überflüssig
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Signalwerte und aktuelle Untersuchungsergebnisse
- Krebserregendes Glycidamid in Chips und Pommes – NZZ Online, 18. August 2008
- CIAA Acrylamide Toolbox. (PDF; 265 kB) Europäischen Verband der Lebensmittelindustrie (CIAA), Dezember 2007 (englisch): „The CIAA “Toolbox” reflects the results of several years of industry cooperation to understand acrylamide formation and potential intervention steps.“
- Acrylamid – Informationen des Bundesamts für Lebensmittelsicherheit und Veterinärwesen
- Fragen und Antworten zu Acrylamid – Bundesinstitut für Risikobewertung (BfR). 24. August 2011.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l Eintrag zu Acrylamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b Eintrag zu Acrylamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 690.
- ↑ Eintrag zu Acrylamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 2. November 2015.
- ↑ a b c W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- ↑ Brandrup, J.; Immergut, E.H.; Grulke, E.A.; Abe, A.; Bloch, D.R.: Polymer Handbook, 4th Edition, Wiley-VCH 2003, ISBN 978-0-471-47936-9, S. II/368.
- ↑ L. A. Mucci, P. W. Dickman, G. Steineck, H.-O. Adami, K. Augustsson: Dietary acrylamide and cancer of the large bowel, kidney, and bladder: Absence of an association in a population-based study in Sweden. In: British Journal of Cancer. 88, 2003, S. 84, doi:10.1038/sj.bjc.6600726.
- ↑ a b Pressemeldung der Medizinischen Hochschule Hannover: Acrylamid im Blut: Rolle des Ernährungsverhaltens unklar. 5. Oktober 2005, abgerufen am 6. Februar 2020.
- ↑ E. Tareke, P. Rydberg, P. Karlsson, S. Eriksson, M. Törnqvist: Acrylamide: a cooking carcinogen? In: Chemical Research in Toxicology. Band 13, Nummer 6, Juni 2000, S. 517–522, PMID 10858325.
- ↑ E. Tareke, P. Rydberg, P. Karlsson, S. Eriksson, M. Törnqvist: Analysis of acrylamide, a carcinogen formed in heated foodstuffs. In: Journal of agricultural and food chemistry. Band 50, Nummer 17, August 2002, S. 4998–5006, PMID 12166997.
- ↑ Udo Pollmer: Kartoffel: Acrylamid – Viel Rauch um nichts ( vom 24. November 2007 im Internet Archive) In: EU.L.E.n-Spiegel. 02/2006.
- ↑ D. S. Mottram, B. L. Wedzicha, A. T. Dodson: Food chemistry: Acrylamide is formed in the Maillard reaction. In: Nature. 419, 2002, S. 448–449. PMID 12368844.
- ↑ Richard H. Stadler, Alfred Studer: Chapter 1 – Acrylamide Formation Mechanisms. In: Acrylamide in Food. Academic Press, 2016, ISBN 978-0-12-802832-2, S. 1–17, doi:10.1016/b978-0-12-802832-2.00001-2.
- ↑ Wie Schwefel im Boden Acrylamid im Brot verringert. In: wissenschaft.de. 2. April 2007, abgerufen am 8. September 2019.
- ↑ M. Raters, R. Matissek: Das Minimierungskonzept von Acrylamid bei Kartoffelchips: Eine nachhaltige Erfolgsgeschichte. In: Lebensmittelchemie. Nr. 64, 2010, S. 40–41.
- ↑ M. Raters, R. Matissek: 10 Jahre Acrylamid – Rückblick und Status quo. In: Deutsche Lebensmittel Rundschau. Nr. 108, 2012, S. 184–189.
- ↑ a b Volltext der Verordnung (EU) 2017/2158
- ↑ EU verbietet starkes Frittieren von Pommes, Spiegel Online, 10. April 2018.
- ↑ Quellen für Acrylamid in Kosmetika. (PDF; 8 kB). Bundesinstitut für Risikobewertung (BfR), 2003.
- ↑ May Bin-Jumah, Abdel-Fattah M. Abdel-Fattah, Essa M. Saied, Hesham R. El-Seedi, Mohamed M. Abdel-Daim: Acrylamide-induced peripheral neuropathy: manifestations, mechanisms, and potential treatment modalities. In: Environmental Science and Pollution Research. Band 28, Nr. 11, 1. März 2021, S. 13031–13046, doi:10.1007/s11356-020-12287-6.
- ↑ Juanying Ou, Jie Zheng, Junqing Huang, Chi-Tang Ho, Shiyi Ou: Interaction of Acrylamide, Acrolein, and 5-Hydroxymethylfurfural with Amino Acids and DNA. In: Journal of Agricultural and Food Chemistry. Band 68, Nr. 18, 6. Mai 2020, S. 5039–5048, doi:10.1021/acs.jafc.0c01345.
- ↑ Adriana Nowak, Małgorzata Zakłos-Szyda, Dorota Żyżelewicz, Agnieszka Koszucka, Ilona Motyl: Acrylamide Decreases Cell Viability, and Provides Oxidative Stress, DNA Damage, and Apoptosis in Human Colon Adenocarcinoma Cell Line Caco-2. In: Molecules. Band 25, Nr. 2, Januar 2020, S. 368, doi:10.3390/molecules25020368, PMID 31963203, PMC 7024287 (freier Volltext) – (mdpi.com [abgerufen am 16. April 2022]).
- ↑ Some industrial chemicals (= IARC monographs on the evaluation of carcinogenic risks to humans. Band 60). IARC, Lyon 1994, ISBN 978-92-832-1260-7 (iarc.fr).
- ↑ Frequently asked questions – acrylamide in food ( vom 20. Dezember 2013 im Internet Archive), Antwort zu Frage 4, Abs. 3.
- ↑ Acrylamid in Lebensmitteln ist ein Problem für die öffentliche Gesundheit. EFSA, 4. Juni 2015.
- ↑ L. A. Mucci, P. W. Dickman, G. Steineck, H. O. Adami, K. Augustsson: Dietary acrylamide and cancer of the large bowel, kidney, and bladder: absence of an association in a population-based study in Sweden. In: British Journal of Cancer. Band 88, Nummer 1, Januar 2003, S. 84–89, doi:10.1038/sj.bjc.6600726. PMID 12556964, PMC 2376776 (freier Volltext).
- ↑ C. Pelucchi, C. Bosetti, C. Galeone, C. La Vecchia: Dietary acrylamide and cancer risk: an updated meta-analysis. In: International Journal of Cancer. Band 136, Nummer 12, Juni 2015, S. 2912–2922, doi:10.1002/ijc.29339. PMID 25403648 (Review).
- ↑ Feng Jiang, Min Teng, Yan-Xin Zhu, Yong-Jie Li: No association between dietary acrylamide and renal cell carcinoma: an updated meta-analysis. In: Journal of the Science of Food and Agriculture. Band 100, Nr. 7, Mai 2020, S. 3071–3077, doi:10.1002/jsfa.10339, PMID 32077494.
- ↑ C. Pelucchi, V. Rosato, P. M. Bracci, D. Li, R. E. Neale, E. Lucenteforte, D. Serraino, K. E. Anderson, E. Fontham, E. A. Holly, M. M. Hassan, J. Polesel, C. Bosetti, L. Strayer, J. Su, P. Boffetta, E. J. Duell, C. La Vecchia: Dietary acrylamide and the risk of pancreatic cancer in the International Pancreatic Cancer Case-Control Consortium (PanC4). In: Annals of Oncology: Official Journal of the European Society for Medical Oncology. Band 28, Nr. 2, 1. Februar 2017, S. 408–414, doi:10.1093/annonc/mdw618, PMID 27836886, PMC 6246541 (freier Volltext).
- ↑ Sanaz Benisi-Kohansal, Asma Salari-Moghaddam, Zahraalsadat Seyed Rohani, Ahmad Esmaillzadeh: Dietary acrylamide intake and risk of women's cancers: a systematic review and meta-analysis of prospective cohort studies. In: The British Journal of Nutrition. Band 126, Nr. 9, 14. November 2021, S. 1355–1363, doi:10.1017/S0007114520005255, PMID 33413725.
- ↑ Youjin Je: Dietary acrylamide intake and risk of endometrial cancer in prospective cohort studies. In: Archives of Gynecology and Obstetrics. Band 291, Nr. 6, Juni 2015, S. 1395–1401, doi:10.1007/s00404-014-3595-8, PMID 25516180.
- ↑ Giorgia Adani, Tommaso Filippini, Lauren A. Wise, Thorhallur I. Halldorsson, Ludek Blaha, Marco Vinceti: Dietary Intake of Acrylamide and Risk of Breast, Endometrial, and Ovarian Cancers: A Systematic Review and Dose-Response Meta-analysis. In: Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology. Band 29, Nr. 6, Juni 2020, S. 1095–1106, doi:10.1158/1055-9965.EPI-19-1628, PMID 32169997.
- ↑ Xintong Tan, Jin Ye, Weiqi Liu, Beita Zhao, Xu Shi: Acrylamide aggravates cognitive deficits at night period via the gut–brain axis by reprogramming the brain circadian clock. In: Archives of Toxicology. Band 93, Nr. 2, 1. Februar 2019, S. 467–486, doi:10.1007/s00204-018-2340-7.
- ↑ Zhao-min Liu, Lap Ah Tse, Bailing Chen, Suyang Wu, Dicken Chan: Dietary acrylamide exposure was associated with mild cognition decline among non-smoking Chinese elderly men. In: Scientific Reports. Band 7, Nr. 1, 25. Juli 2017, S. 6395, doi:10.1038/s41598-017-06813-9, PMID 28743904, PMC 5527102 (freier Volltext).
- ↑ Manokaran Kalaivani, Ummer Velladath Saleena, Karthik Ganapathi Kamath Katapadi, Yekula Praveen Kumar, Deepak K. Nayak, Nilima: Effect of Acrylamide Ingestion on Reproductive Organs of Adult Male Wistar Rats. In: Journal of Clinical and Diagnostic Research. 2018 doi:10.7860/JCDR/2018/38170.12364.
- ↑ Jong-Su Park, Palas Samanta, Sangwoo Lee, Jieon Lee, Jae-Woo Cho: Developmental and Neurotoxicity of Acrylamide to Zebrafish. In: International Journal of Molecular Sciences. Band 22, Nr. 7, Januar 2021, S. 3518, doi:10.3390/ijms22073518, PMID 33805345, PMC 8037265 (freier Volltext) – (mdpi.com [abgerufen am 16. April 2022]).
- ↑ Manik Kadawathagedara, Jérémie Botton, Blandine de Lauzon-Guillain, Helle Margrete Meltzer, Jan Alexander: Dietary acrylamide intake during pregnancy and postnatal growth and obesity: Results from the Norwegian Mother and Child Cohort Study (MoBa). In: Environment International. Band 113, 1. April 2018, S. 325–334, doi:10.1016/j.envint.2018.01.004.
- ↑ Bundesinstitut für Risikobewertung: Expositionsabschätzung Acrylamid.
- ↑ Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): Informationsblatt zu Acrylamid. Abgerufen am 3. Mai 2023.
- Giftiger Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Gesundheitsschädlicher Stoff bei Einatmen
- Hautreizender Stoff
- Sensibilisierender Stoff
- Augenreizender Stoff
- Erbgutverändernder Stoff
- Krebserzeugender Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- CMR-Stoff
- SVHC-Stoff
- Alkensäureamid
- Vinylverbindung
- Kaffeeinhaltsstoff
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 29
- Beschränkter Stoff nach REACH-Anhang XVII

