Amonia bisulfido
| Amonia bisulfido | |||||
 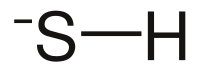
| |||||
| Kemia strukturo de la Amonia bisulfido | |||||
| |||||
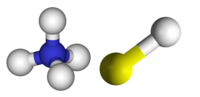
| 3D Kemia strukturo de la Amonia bisulfido | |||||

| |||||
| Sulfida erco pirargirito | |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 12124-99-1 | ||||
| ChemSpider kodo | 23805 | ||||
| PubChem-kodo | 25515 | ||||
| Fizikaj proprecoj | |||||
| Aspekto |
| ||||
| Molmaso | 51,111 g mol−1 | ||||
| Denseco |
| ||||
| Refrakta indico | 1,74 | ||||
| Bolpunkto | 56.6 °C (133.9 ℉; 329.8 K) | ||||
| Solvebleco |
| ||||
| Nesolvebleco | |||||
| Ekflama temperaturo | 71,6 °C | ||||
| Mortiga dozo (LD50) | 168 mg/kg (muso, buŝa) | ||||
| Sekurecaj Indikoj | |||||
| Risko | R11 R23 R24 R25 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj[2] | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H314, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P264, P273, P280, P301+330+331, P303+361+353, P304, P305+351+338, P310, P321, P363, P391, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Amonia bisulfido, bisulfido de amonio aŭ NH4HS estas kemia substanco, bisulfida salo derivita el reakcio inter la amonia hidroksido kaj sulfida acido. La salo estas senkolora, akvosolvebla kaj glimeca kristalo.
Sur la Tero, la komponaĵo trovatas ĉefe kiel akvosolvaĵo, malofte kiel solido, tamen, oni kredas ke bisulfido de amonio estas grava komponanto en la atmosfero de la gigantaj planedoj samkiel Jupitero kaj Saturno, kie sulfuro estiĝas pere de ĝia fotolizo respondeca pri la malsamaj koloroj de la nuboj sur tiuj planedoj. Amonia bisulfido povas generiĝi per miksado de sulfida acido kaj amoniako.
Preparado
[redakti | redakti fonton]Solvaĵoj de amonia hidrogena sulfido povas prepariĝi per pasado de sulfida acido tra koncentrita solvajo de amoniako. Laŭ raportoj priskribitaj en 1895, hidrogena sulfido reakcias kun koncentrita amoniaka solvaĵo ĉe meditemperaturo por estigi (NH4)2S kaj NH4HS. Glacifrosta solvaĵo de ĉi-substanco konservita ĉe 0 °C kaj sub daŭra senĉesa pasado de hidrogena sulfido tra ĝi estigas la amonian sulfidon.
La ordinara "fetora bombo" konsistas je akvosolvaĵo de amonia sulfido. La miksaĵo konvertiĝas en gasojnamoniakon kaj hidrogenan sulfidon. Akvosolvaĵoj de amonia bisulfido iompostiom flaviĝas pro malkomponiĝo kaj estigo de hidrogena sulfido. Ĝi estas tre irita kiam inhalita kaj ĝiaj vaporoj povas esti fatalaj.
Reakcioj
[redakti | redakti fonton]Sintezo de la hidrogena amonia sulfido kun sulfida acido:
Amonia bisulfido malkomponiĝas sub malaltaj temperaturoj[3]:
Ĝi reakcias kun diluitaj acidoj:
Kun koncentrita nitrata acido ĝi oksidiĝas:
Iompostiom ĝi oksidiĝas en la aero por estigi variaĵon da produktoj:
Kun troo da amoniako ĝi dissolvas lasulfuron por estigi polisulfidoj:
Amonia bisulfido estis detektita en la atmosfero de Jupitero tuj post ĝia kolizio kun la kometo Shoemaker-Levy. La ekvilibro inter amoniako, sulfida acido kaj amonia bisulfido priskribiĝas en la sekva ekvacio[4]:
Literaturo
[redakti | redakti fonton]- Handbook of Inorganic Compounds, Second Edition, Dale L. Perry
- Corrosion Engineering, Volkan Cicek
- Handbook of Dangerous Properties of Inorganic And Organic Substances in ..., Ya. M. Grushko
- Cameo Chemicals
- Chemical Data Guide for Bulk Shipment by Water: Sprial-Bound, United States. Coast Guard
- Mallinckrodt Chemicals Arkivigite je 2016-08-30 per la retarkivo Wayback Machine
- What type of climate is there on Jupiter?
- UCBerkeleyNews
| ||||||
Referencoj
[redakti | redakti fonton]- ↑ Merck Index 15-a eldono, Merck-nombroj 498 kaj 499.
- ↑ Thermo Fischer[rompita ligilo]
- ↑ Cathodic Protection: Industrial Solutions for Protecting Against Corrosion, Volkan Cicek
- ↑ Jupiter's atmosphere. Arkivita el la originalo je 2016-03-05. Alirita 2015-07-30.






