Ácido perclórico
Apariencia
| Ácido perclórico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido tetraoxoclórico (VII) | ||
| General | ||
| Otros nombres | Tetraoxoclorato (VII) de hidrógeno | |
| Fórmula molecular | ?HClO4 | |
| Identificadores | ||
| Número CAS | 7601-90-3[1] | |
| Propiedades físicas | ||
| Masa molar | 100,46 g/mol | |
| Punto de fusión | 255 K (−18 °C) | |
| Punto de ebullición | 476 K (203 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Miscible | |
| Peligrosidad | ||
| SGA |
  [2] [2] | |
| NFPA 704 |
0
3
3
OX
| |
| Ácido cloroso | ||
| Ácido hipocloroso | ||
| Ácido clórico | ||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||

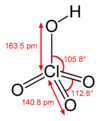
Ácido perclórico es la denominación que se le otorga al ácido que resulta de la unión del óxido perclórico con H2O. Recibe tal nombre debido a que el cloro actúa con el estado de oxidación +7, que es el mayor de los cuatro que posee el (+1, +3, +5 y +7).
Es un ácido muy fuerte que tiene la magnitud más baja de pKa de los ácidos, por lo que en disolución acuosa se disocia totalmente. Es altamente corrosivo, y a concentraciones superiores al 72% es inestable y puede resultar explosivo, por lo que se deben tomar precauciones al manipularlo.
Fórmula química
[editar]La fórmula del ácido perclórico es HClO4, y se obtiene por los siguientes pasos:
- Formación del óxidos ácidos:
- 2 Cl2 + 7 O2 → 2 Cl2O7
- Formación del ácido:
- Cl2O7 + H2O → 2 HClO4
Referencias
[editar]- ↑ Número CAS
- ↑ «Perchloric acid» (en inglés). Sigma-Aldrich. Consultado el 30 de octubre de 2017.


