ایمنی جمعی

ایمنی جمعی یا ایمنی گلهای[۱] (همچنین به آن اثر گله، مصونیت جامعه، ایمنی جمعیت یا ایمنی اجتماعی گفته میشود) نوعی محافظت غیرمستقیم از بیماریهای عفونی است که زمانی اتفاق میافتد که درصد زیادی از جمعیت در اثر عفونت، از طریق عفونتهای قبلی یا واکسیناسیون مصون شوند. از این طریق میتوان از افرادی که مصون نیستند، در مقابل بیماری حفاظت کرد.[۲][۳] در جمعیتی که بخش اعظمی از افراد از مصونیت برخوردار هستند، چنین افرادی در انتشار بیماری سهمی ندارند و زنجیرههای انتشار عفونت مختل میشوند که این امر یا سبب توقف یا کند شدن شیوع بیماری میشود.[۴] هرچه نسبت افراد مصون در یک جامعه بیشتر باشد، احتمال تماس افراد غیرایمنی با فرد عفونی کمتر میشود و به محافظت افراد غیرمصون از عفونت کمک میکند.
افراد میتوانند با بهبودی از عفونت قبلی یا از طریق واکسیناسیون، مصون شوند.[۴] برخی از افراد به دلایل پزشکی مانند نقص ایمنی یا سرکوب سیستم ایمنی بدن نمیتوانند ایمن شوند و برای این گروه ایمنی جمعی یک روش مهم محافظت است.[۵][۶] پس از رسیدن آستانه مشخص، ایمنی جمعی بهتدریج بیماری را از بین میبرد. این حذف در صورت دستیابی به سراسر جهان ممکن است منجر به کاهش دائمی تعداد عفونتها به صفر شود که در نهایت سبب ریشهکن شدن بیماری میشود.[۷] ایمنی جمعی ایجادشده از طریق واکسیناسیون به ریشهکن کردن نهایی آبله در ۱۹۷۷ و به کاهش فراوانی سایر بیماریها کمک کردهاست.[۸] ایمنی جمعی در مورد همه بیماریها عمل نمیکند و فقط در مورد بیماریهای مسری که در آنها انتقال از یک فرد به فرد دیگر است، عمل میکند. به عنوان مثال، کزاز، یک بیماری عفونی است اما مسری نیست؛ بنابراین، ایمنی جمعی در مورد آن عمل نمیکند.
ایمنی جمعی به عنوان یک پدیده طبیعی در دهه ۱۹۳۰ شناخته شد که مشاهده شد بعد از اینکه تعداد قابل توجهی از کودکان از سرخک مصون شدند، تعداد عفونتهای جدید بهطور موقت، حتی در بین کودکان مستعد کاهش یافتهاست.[۹] واکسیناسیون دسته جمعی برای القای ایمنی جمعی از زمان رایج و در جلوگیری از شیوع بسیاری از بیماریهای عفونی موفقیتآمیز بودهاست.[۱۰] مخالفت با واکسیناسیون، ایمنی جمعی را به چالش کشیدهاست، و امکان دارد بیماریهای قابل پیشگیری در جوامعی که میزان واکسیناسیون ناکافی دارند همچنان ادامه داشته یا به آن بازگردند.[۱۱][۱۲][۱۳]
اثرات
[ویرایش]محافظت از افراد بدون مصونیت
[ویرایش]بعضی از افراد نمیتوانند با واکسیناسیون ایمنی ایجاد کنند یا به دلایل پزشکی نمیتوانند واکسینه شوند.[۱۴][۵][۱۵] نوزادان تازه متولد شده، یا به دلایل ایمنی یا به دلیل ایمنی منفی واکسنهای زیادی را نمیتوانند دریافت نمایند.[۱۶] افرادی که به دلیل ایدز، لنفوم، لوسمی، سرطان مغز استخوان، طحال دچار اختلال، شیمی درمانی یا رادیوتراپی از نقص ایمنی برخوردار هستند، ممکن است ایمنی قبلی را از دست داده باشند و واکسنها به دلیل نقص ایمنی ممکن است برای آنها فایده ای نداشته باشد.[۱۷]
واکسنها بهطور معمول ناقص هستند، زیرا ممکن است سیستم ایمنی برخی از افراد پاسخ ایمنی کافی به واکسنها برای اعطای مصونیت طولانی مدت ایجاد نکند، بنابراین بخشی از کسانی که واکسینه میشوند ممکن است ایمنی نداشته باشند.[۲][۱۸][۱۹] در آخر اینکه، موارد منع مصرف واکسن ممکن است از واکسیناسیون برخی افراد جلوگیری کند.[۱۵] علاوه بر عدم مصون بودن، ممکن است افراد یکی از این گروهها به دلیل وضعیت پزشکی در معرض خطر عوارض ناشی از عفونت قرار بگیرند، اما درصورتیکه درصد کافی از جمعیت در امان باشند، ممکن است در مقابل بیماری محافظت شوند.[۵][۲۰]
ایمنی زیاد در یک گروه سنی میتواند برای سایر گروههای سنی ایمنی جمعی ایجاد کند.[۸] واکسیناسیون بزرگسالان دربرابر سیاه سرفه، میزان بروز آن را در نوزادان نیز، که بیشترین خطر عوارض ناشی از این بیماری را دارند، کاهش میدهد.[۲۱][۲۲] این امر به ویژه برای اعضای نزدیک خانواده، که بیشترین انتقالها را به نوزادان جوان انجام میدهند، بسیار مهم است.[۱۹] با همین روش، کودکانی که واکسن علیه پنوموکوک دریافت میکنند، شیوع بیماری پنوموکوکی را در بین خواهر و برادرهای جوان و واکسینه نشده کاهش میدهد.[۲۳] واکسیناسیون کودکان علیه پنوموکوک و روتاویروس سبب کاهش پنوموکوک - و روتاویروس - در کودکان بزرگتر و بزرگسالان که بهطور معمول این واکسنها را دریافت نمیکنند، میشود.[۲۴][۲۵] آنفلوانزا (آنفولانزا) در افراد مسن نسبت به گروههای سنی جوان شدیدتر است، اما واکسن آنفلوانزا به دلیل کم شدن سیستم ایمنی بدن با افزایش سن، در این جمعیت مؤثر نیست.[۲۶] اولویت بندی کودکان سن مدرسه برای واکسیناسیون آنفولانزای فصلی، که مؤثرتر از واکسیناسیون سالمندان است، برای افراد مسن میزان خاصی از محافظت را ایجاد میکند.
برای عفونتهای مقاربتی (STI)، سطح بالای ایمنی در یک جنس باعث ایمنی جمعی برای هر دو جنس میشود.[۱۰][۲۷][۲۸] واکسنهای ضد STI که در یک جنس استفاده میشود، در صورتی که میزان واکسن در جنس مزبور بالا باشد، در کاهش بیماری در هر دو جنس تأثیر چشمگیر دارد.[۲۹] با این حال، ایمنی جمعی از واکسیناسیون زنان، در مردان همجنسگرا گسترش نمییابد. اگر جذب واکسن در بین جنس مورد نظر کم باشد، ممکن است جنس دیگر لازم باشد که ایمنسازی شود تا از جنس هدف به اندازه کافی محافظت شود. رفتارهای پرخطر، از بین بردن STIها را دشوار میکند، اگرچه بیشتر عفونتها در بین افراد دارای ریسک متوسط اتفاق میافتد، بیشتر انتقالها به دلیل افرادی است که درگیر رفتارهای پرخطر هستند. به همین دلایل، در برخی از جمعیتها ممکن است ایمنسازی افراد پرخطر یا افراد هر دو جنس برای ایجاد ایمنی جمعی لازم باشد.
فشار تکاملی
[ویرایش]ایمنی جمعی خود به عنوان یک فشار تکاملی بر روی برخی ویروسها عمل میکند، و با تشویق به تولید سویههای جدید، تکامل ویروسی را تحت تأثیر قرار میدهد، از این مورد به عنوان جهشهای فرار که قادر به «فرار» از ایمنی جمعی هستند و راحت تر گسترش مییابند، یاد میشود.[۳۰][۳۱] در سطح مولکولی، ویروسها از طریق رانش آنتیژنی از ایمنی جمعی فرار میکنند، یعنی زمانی که جهشها در بخشی از ژنوم ویروسی که برای آنتیژن سطح ویروس رمزگذاری میشود، جمع میشوند، بهطور معمول پروتئین کپسید ویروس، باعث ایجاد تغییر در اپی توپ ویروسی میشود.[۳۲][۳۳] از طرف دیگر، انتقال مجدد بخشهای ژنوم جدا شده ویروسی یا تغییر آنتیژن که معمولاً در صورت وجود فشارهای بیشتر در گردش خون وجود دارد، میتواند سروتیپهای جدیدی تولید کند.[۳۴] هنگامی که هر یک از این موارد اتفاق بیفتد، لنفوسیت تی خاطره دیگر ویروس را تشخیص نمیدهند، بنابراین مردم در مقابل فشار غالب گردش خون مصون نیستند. برای هر دو آنفلوانزا و نورو ویروس، همه گیرها به طور موقت ایمنی جمعی را القا میکنند تا ظهور یک سویه غالب جدید، باعث ایجاد امواج پی در پی همه گیر شود. از آنجا که این تکامل، ایمنی جمعی را به چالش میکشد، آنتیبادیها بهطور گسترده خنثی میشوند و واکسنهای «جهانی» که میتوانند محافظت فراتر از یک سروتیپ خاص باشند، در حال توسعه هستند.[۳۵][۳۶]
جایگزینی سروتیپ
[ویرایش]سروتیپ جایگزین، یا تغییر سروتیپ، ممکن است رخ دهد اگر شیوع یک سروتیپ با توجه به سطح بالایی از ایمنی، کاهش یابد اجازه میدهد سروتیپهای دیگر به جای آن جایگزین شوند.[۳۷][۳۸] واکسنهای اولیه علیه استرپتوکوک نومونیا به طور قابل توجهی سروتیپهای نازوفارنکس (VTs)، از جمله انواع مقاوم به آنتیبیوتیک را کاهش میدهد،[۲۳][۳۹] اما این کاهش، فقط با افزایش سروتیپهای غیر واکسن (NVTs) جبران میشود. این افزایش به همان نسبت سبب بروز بیماری نمیشود، ااین بدان جهت است که NVTs کمتر از VTs تهاجمی است. از آن زمان، واکسنهای پنوموکوکی که از محافظت از سروتیپهای نوظهور محافظت میکنند، معرفی شدهاند و با موفقیت در مقابل ظهور سروتیپهای جدید عمل میکنند.
ریشه کن کردن بیماریها
[ویرایش]
اگر ایمنی جمعی در یک جمعیت برای مدت زمان کافی برقرار و حفظ شده باشد، بیماری به ناچار از بین میرود - دیگر انتقال آندمیک رخ نمیدهد.[۶] اگر در سرتاسر جهان حذف انجام شود و تعداد موارد بهطور دائم به سمت صفر کاهش یابد، میتوان بیماری را ریشه کن کرد.[۷] از این رو ریشه کن کردن میتواند اثر نهایی یا نتیجه نهایی تلاشهای بهداشت عمومی برای کنترل شیوع بیماریهای عفونی در نظر گرفته شود.[۸]
فواید ریشه کن کردن شامل پایان دادن به همه عوارض و مرگ و میر ناشی از این بیماری، پسانداز مالی برای افراد، ارائه دهندگان مراقبتهای بهداشتی و دولتها و امکان استفاده از منابع مورد استفاده برای کنترل بیماری در جای دیگر است.[۷] تا به امروز، دو بیماری با استفاده از ایمنی جمعی و واکسیناسیون ریشهکن شدهاست: طاعون گاوی و آبله.[۲][۸][۴۰] تلاشهای ریشه کنی که به ایمنی جمعی تکیه میکنند، در حال حاضر برای انجام فلج اطفال انجام میشود، اگرچه ناآرامیهای داخلی و عدم اعتماد به طب مدرن این مسئله را دشوار کردهاست.[۴۱] اگر افراد کافی واکسیناسیون انجام ندهند، واکسیناسیون اجباری در تلاش برای ریشه کن کردن مفید است.[۴۲][۴۳][۴۴][۴۵]
سواری مجانی
[ویرایش]ایمنی جمعی در برابر معضل مفتسواری آسیبپذیر است.[۴۶] افرادی که ایمنی ندارند، به ویژه افرادی که واکسینه نمیکنند، از ایمنی جمعی ایجاد شده توسط کسانی که مصون هستند، سود میبرند. با افزایش تعداد مفتسواران در یک جمعیت، شیوع بیماریهای قابل پیشگیری به دلیل از بین رفتن ایمنی جمعی شایع تر و شدیدتر میشود.[۱۱][۱۲][۱۳][۴۳][۴۵] افراد ممکن است به دلایل مختلفی، از جمله تصور ناکارآمدی واکسن، مفتسواری را انجام دهند. برخی نیز معتقدند که خطرات مرتبط با واکسن بیشتر از موارد مرتبط با عفونت است[۲] همچنین بیاعتمادی به واکسنها یا مقامات بهداشت عمومی،[۴۷] اثر ارابه موسیقی یا گروهزدگی،[۴۸] هنجارهای اجتماعی یا فشار نظیر،[۴۹] و اعتقادات مذهبی نیز ممکن است سبب این مفتسواری شوند. اگر تعداد واکسیناسیون به اندازه کافی بالا باشد، احتمالاً برخی افراد واکسن دریافت نخواهند کرد، بنابراین فرد را متقاعد میکند که ممکن است نیازی به واکسیناسیون نداشته باشد، زیرا درصد کافی از دیگران در حال حاضر مصون هستند.
مکانیک
[ویرایش]| مرض | انتقال | R 0 | اصابت |
|---|---|---|---|
| سرخک | هوابرد | ۱۲–۱۸ | ۹۲–۹۵٪ |
| سیاهسرفه | قطره هوا | 12–17[۵۱] | ۹۲–۹۴٪ |
| دیفتری | بزاق | ۶–۷ | ۸۳–۸۶٪ |
| سرخچه | قطره هوا | ||
| ابله | ۵–۷ | ۸۰–۸۶٪ | |
| فلج اطفال | مسیر مدفوع-دهانی | ||
| اوریون | قطره هوا | ۴–۷ | ۷۵–۸۶٪ |
| سارس {{سخ}} (شیوع SARS 2002-2004) |
2–5[۵۲] | ۵۰–۸۰٪ | |
| کووید 19 {{سخ}} (همه گیر کرونویروس 2019-2020) |
1.4–3.9[۵۳][۵۴] | ۲۹–۷۴٪ | |
| ابولا {{سخ}} (اپیدمی ویروس ابولا در غرب آفریقا) |
مایعات بدن | 1.5-2.5[۵۵] | ۳۳–۶۰٪ |
| آنفلوانزا {{سخ}} (بیماری همه گیر آنفلوانزا) |
قطره هوا | ۱٫۵–۱٫۸ | ۳۳–۴۴٪ |
افرادی که از یک بیماری مصون هستند، به عنوان مانعی در گسترش بیماری، کندی یا جلوگیری از انتقال بیماری به دیگران عمل میکنند.[۴] مصونیت فرد از طریق یک عفونت طبیعی یا از طریق مصنوعی مانند واکسیناسیون قابل دستیابی است. هنگامی که بخش مهمی از جمعیت، به نام آستانه ایمنی جمعی (HIT) یا سطح ایمنی جمعی(HIL)، مصونیت مییابد، ممکن است این بیماری دیگر در جمعیت پابرجا نماند و تبدیل به یک بیماری محلی و بومی شود.[۶][۳۰]
این آستانه را میتوان با در نظر گرفتن R 0، عدد تکثیر پایه یا میانگین تعداد عفونتهای جدید ناشی از هر مورد در یک جمعیت کاملاً مستعد یکدست و یکپارچه، محاسبه کرد، به این معنی که هر فرد میتواند با هر شخص دیگری در تماس باشد. فرد مستعد در جمعیت،[۱۰][۳۰][۴۲] و ضرب آن با S، نسبت جمعیتی که مستعد ابتلا به عفونت هستند:
S را میتوان به صورت(1 - p) نوشت زیرا p نسبتی از جمعیت است که ایمن هستن و p + S برابر با یک است. سپس میتوان دوباره معادله را تنظیم کرد تا p به صورت زیر قرار گیرد:
- → →
با وجود اینکه p به خودی خود در سمت چپ معادله قرار دارد، اکنون میتوان آن را به عنوان p c نوشت تا نمایانگر نسبت مهم جمعیت مورد نیاز برای مصون ماندن برای جلوگیری از انتقال بیماری یا «آستانه ایمنی جمعی» باشد.[۱۰] R 0 به عنوان یک تخمینی از سرایت عمل میکند، بنابراین مقدار کم R 0 مقدار ابتلای کمتر است، در حالی که R 0 بالاتر منتج به میزان ابتلای بیشتر است[۳۰][۴۲] به عنوان مثال، میزان ابتلا به یک بیماری (HIT) با R 0 برابر با ۲، از نظر تئوری فقط ۵۰٪ است، در حالی که برای بیماری با R 0 برابر ۱۰، از نظر تئوری میزان ابتلا ۹۰٪ است.
این محاسبات فرض میکند که کل جمعیت مستعد است، به این معنی که هیچ فردی در برابر این بیماری مصون نیست. در واقعیت، نسبتهای مختلفی از جمعیت در برابر هر بیماری خاص در هر زمان معین مصون هستند.[۱۰] برای آنکه این موضوع در محاسبات منظور شود، عدد مؤثر باروری Re، که بصورت R T نیز نوشته میشود، یا متوسط تعداد عفونتها در زمان t، از حاصلضرب R 0 در کسری از جمعیت که هنوز در معرض بیماریاند، قابل محاسبه است. با کاهش R و باقی ماندن آن زیر ۱، تعداد مواردی که در جمعیت رخ میدهد به تدریج کاهش مییابد تا زمانی که بیماری از بین برود.[۳۰][۵۶]
فرض دوم در این محاسبات این است که جمعیتها یکدست یا کاملاً توزیع شده هستند، به این معنی که هر فرد با هر فرد دیگری در تماس است، درحالی که در واقعیت جوامع به صورت شبکههای با هم ارتباط دارند که در آن افراد در دستههایی دور هم جمع شدهاند، به گونه ای که هر فرد با تعداد معدودی افراد ارتباط دارد. در این شبکهها، انتقال فقط بین افرادی که از لحاظ جغرافیایی یا جسمی به یکدیگر نزدیک هستند، انجام میشود.[۲][۴۲][۴۳] شکل و اندازه یک شبکه میزان شیوع یک بیماری را کم و بیش تحت تأثیر قرار میدهد.[۳۰]
++
تاریخ
[ویرایش]
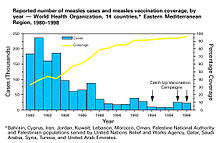
ایمنی جمعی نخستین بار در دهه ۱۹۳۰ به عنوان یک پدیده طبیعی شناخته شد که هدریچ در مورد اپیدمیولوژی سرخک در بالتیمور تحقیقاتی را منتشر کرد و توجه داشت که پس از ایمنی بسیاری از کودکان در مقابل سرخک، تعداد عفونتهای جدید از جمله در بین کودکان مستعد، بهطور موقت کاهش یافتهاست.[۹] علیرغم این دانش، تلاشها برای کنترل و از بین بردن سرخک ناموفق بود تا اینکه واکسیناسیون دسته جمعی با استفاده از واکسن سرخک در دهه ۱۹۶۰ آغاز شد. واکسیناسیون گسترده، بحثهای مربوط به ریشه کن کردن بیماری و تجزیه و تحلیل هزینه و فایده واکسیناسیون متعاقباً باعث استفاده گستردهتر از اصطلاح ایمنی جمعی شد.[۲] در دهه ۱۹۷۰، قضیه مورد استفاده برای محاسبه آستانه ایمنی جمعی بیماری توسعه یافت. در طول کمپین ریشه کنی آبله در دهه ۱۹۶۰و ۱۹۷۰، عمل واکسیناسیون حلقه، به عنوان راهی برای ایمنسازی هر فرد در یک «حلقه» در اطراف فرد آلوده شروع شد تا از شیوع آن جلوگیری شود.[۵۷]
از زمان پذیرش واکسیناسیون دسته جمعی و حلقه ای، پیچیدگیها و چالشهایی در مورد ایمنی جمعی بوجود آمدهاست.[۲][۵۸] در مدلسازی شیوع بیماری عفونی در ابتدا فرضیات زیادی منظور شدهاست، که ممترین آنها این است که کل جمعیت مستعد هستند و جمعیت یکدست است که در واقعیت وجود ندارد، بنابراین معادلات دقیق تری ایجاد شدهاست. در دهههای اخیر، به رسمیت شناخته شدهاست که سویه غالب یک میکروارگانیسم در گردش ممکن است به دلیل ایمنی جمعی تغییر کند، یا به دلیل ایمنی جمعی که به عنوان یک فشار تکاملی عمل میکند یا اینکه به دلیل ایمنی جمعی در برابر یک سویه، امکان گسترش گونه قبلی موجود را فراهم میکند.[۳۲][۳۸] مشاجرات موجود یا نوظهور علیه واکسن و دلایل مختلف مخالفت با واکسیناسیون، ایمنی جمعی را در برخی از جوامع کاهش داده یا از بین بردهاست و به بیماریهای قابل پیشگیری اجازه میدهد در این جوامع ادامه پیدا کنند یا بازگردند.[۱۱][۱۲][۱۳]
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ "طرح ایمن سازی دسته جمعی یا گلهای از نظر علمی منسوخ شده است". ایسنا. 25 March 2020. Retrieved 2021-07-01.
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ ۲٫۴ ۲٫۵ ۲٫۶ Fine, P.; Eames, K.; Heymann, D. L. (1 April 2011). "'Herd immunity': A rough guide". Clinical Infectious Diseases. 52 (7): 911–16. doi:10.1093/cid/cir007. PMID 21427399.
- ↑ Gordis, L. (2013). Epidemiology. Elsevier Health Sciences. pp. 26–27. ISBN 978-1-4557-4251-6. Retrieved 29 March 2015.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ Merrill, R. M. (2013). Introduction to Epidemiology. Jones & Bartlett Publishers. pp. 68–71. ISBN 978-1-4496-4517-5. Retrieved 29 March 2015.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ "Herd Immunity". Oxford Vaccine Group, University of Oxford. Retrieved 12 December 2017.
- ↑ ۶٫۰ ۶٫۱ ۶٫۲ Somerville, M.; Kumaran, K.; Anderson, R. (2012). Public Health and Epidemiology at a Glance. John Wiley & Sons. pp. 58–59. ISBN 978-1-118-30864-6. Retrieved 29 March 2015.
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ Cliff, A.; Smallman-Raynor, M. (11 April 2013). Oxford Textbook of Infectious Disease Control: A Geographical Analysis from Medieval Quarantine to Global Eradication. Oxford University Press. pp. 125–36. ISBN 978-0-19-959661-4. Retrieved 29 March 2015.
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ ۸٫۳ Kim, T. H.; Jonhstone, J.; Loeb, M. (September 2011). "Vaccine herd effect". Scandinavian Journal of Infectious Diseases. 43 (9): 683–89. doi:10.3109/00365548.2011.582247. PMC 3171704. PMID 21604922.
- ↑ ۹٫۰ ۹٫۱ Hinman, A. R.; Orenstein, W. A.; Papania, M. J. (1 May 2004). "Evolution of measles elimination strategies in the United States". The Journal of Infectious Diseases. 189 (Suppl 1): S17–22. doi:10.1086/377694. PMID 15106084.
*Sencer, D. J.; Dull, H. B.; Langmuir, A. D. (March 1967). "Epidemiologic basis for eradication of measles in 1967". Public Health Reports. 82 (3): 253–56. doi:10.2307/4592985. JSTOR 4592985. PMC 1919891. PMID 4960501. - ↑ ۱۰٫۰ ۱۰٫۱ ۱۰٫۲ ۱۰٫۳ ۱۰٫۴ Garnett, G. P. (1 February 2005). "Role of Herd Immunity in Determining the Effect of Vaccines against Sexually Transmitted Disease". The Journal of Infectious Diseases. 191 (Suppl 1): S97–106. doi:10.1086/425271. PMID 15627236.
- ↑ ۱۱٫۰ ۱۱٫۱ ۱۱٫۲ Quadri-Sheriff, M.; Hendrix, K. S.; Downs, S. M.; Sturm, L. A.; Zimet, G. D.; Finnell, S. M. (September 2012). "The role of herd immunity in parents' decision to vaccinate children: a systematic review". Pediatrics. 130 (3): 522–30. doi:10.1542/peds.2012-0140. PMID 22926181.
- ↑ ۱۲٫۰ ۱۲٫۱ ۱۲٫۲ Dubé, E.; Laberge, C.; Guay, M.; Bramadat, P.; Roy, R.; Bettinger, J. (August 2013). "Vaccine hesitancy: an overview". Human Vaccines & Immunotherapeutics. 9 (8): 1763–73. doi:10.4161/hv.24657. PMC 3906279. PMID 23584253.
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ Ropeik, D. (August 2013). "How society should respond to the risk of vaccine rejection". Human Vaccines & Immunotherapeutics. 9 (8): 1815–18. doi:10.4161/hv.25250. PMC 3906287. PMID 23807359.
- ↑ Munoz, F. M. (2013). "Maternal immunization: An update for pediatricians". Pediatric Annals. 42 (8): 153–58. doi:10.3928/00904481-20130723-09. PMID 23910028.
- ↑ ۱۵٫۰ ۱۵٫۱ Cesaro, S. ; Giacchino, M. ; Fioredda, F. ; Barone, A. ; Battisti, L. ; Bezzio, S. ; Frenos, S. ; De Santis, R. ; Livadiotti, S. ; Marinello, S. ; Zanazzo, A. G. ; Caselli, D. (2014). "Guidelines on vaccinations in paediatric haematology and oncology patients". Biomed Res. Int. 2014: 707691. doi:10.1155/2014/707691. PMC 4020520. PMID 24868544.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ National Center for Immunization and Respiratory Diseases (2011). "General recommendations on immunization – recommendations of the Advisory Committee on Immunization Practices (ACIP)". MMWR. Recommendations and Reports / Centers for Disease Control. 60 (2): 1–64. PMID 21293327.
- ↑ Wolfe, R. M. (2012). "Update on adult immunizations". The Journal of the American Board of Family Medicine. 25 (4): 496–510. doi:10.3122/jabfm.2012.04.100274. PMID 22773718.
- ↑ Esposito, S; Bosis, S; Morlacchi, L; Baggi, E; Sabatini, C; Principi, N (2012). "Can infants be protected by means of maternal vaccination?". Clinical Microbiology and Infection. 18 Suppl 5: 85–92. doi:10.1111/j.1469-0691.2012.03936.x. PMID 22862749.
- ↑ ۱۹٫۰ ۱۹٫۱ Rakel, D.; Rakel, R. E. (2015). Textbook of Family Medicine. Elsevier Health Sciences. pp. 99, 187. ISBN 978-0-323-31308-7. Retrieved 30 March 2015.
- ↑ Tulchinsky, T. H.; Varavikova, E. A. (26 March 2014). The New Public Health: An Introduction for the 21st Century. Academic Press. pp. 163–82. ISBN 978-0-12-415767-5. Retrieved 30 March 2015.
- ↑ McGirr, A; Fisman, D. N. (2015). "Duration of Pertussis Immunity After DTaP Immunization: A Meta-analysis". Pediatrics. 135 (2): 331–43. doi:10.1542/peds.2014-1729. PMID 25560446.
- ↑ Zepp, F; Heininger, U; Mertsola, J; Bernatowska, E; Guiso, N; Roord, J; Tozzi, A. E.; Van Damme, P (2011). "Rationale for pertussis booster vaccination throughout life in Europe". The Lancet Infectious Diseases. 11 (7): 557–70. doi:10.1016/S1473-3099(11)70007-X. PMID 21600850.
- ↑ ۲۳٫۰ ۲۳٫۱ Pittet, L. F.; Posfay-Barbe, K. M. (2012). "Pneumococcal vaccines for children: A global public health priority". Clinical Microbiology and Infection. 18 Suppl 5: 25–36. doi:10.1111/j.1469-0691.2012.03938.x. PMID 22862432.
- ↑ Nakagomi, O; Iturriza-Gomara, M; Nakagomi, T; Cunliffe, N. A. (2013). "Incorporation of a rotavirus vaccine into the national immunisation schedule in the United Kingdom: A review". Expert Opinion on Biological Therapy. 13 (11): 1613–21. doi:10.1517/14712598.2013.840285. PMID 24088009.
- ↑ Lopman, B. A.; Payne, D. C.; Tate, J. E.; Patel, M. M.; Cortese, M. M.; Parashar, U. D. (2012). "Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011". Current Opinion in Virology. 2 (4): 434–42. doi:10.1016/j.coviro.2012.05.002. PMID 22749491.
- ↑ Kim, T. H. (2014). "Seasonal influenza and vaccine herd effect". Clinical and Experimental Vaccine Research. 3 (2): 128–32. doi:10.7774/cevr.2014.3.2.128. PMC 4083064. PMID 25003085.
- ↑ Lowy, D. R.; Schiller, J. T. (2012). "Reducing HPV-associated cancer globally". Cancer Prevention Research. 5 (1): 18–23. doi:10.1158/1940-6207.CAPR-11-0542. PMC 3285475. PMID 22219162.
- ↑ Lenzi, A; Mirone, V; Gentile, V; Bartoletti, R; Ficarra, V; Foresta, C; Mariani, L; Mazzoli, S; Parisi, S. G. (2013). "Rome Consensus Conference – statement; human papilloma virus diseases in males". BMC Public Health. 13: 117. doi:10.1186/1471-2458-13-117. PMC 3642007. PMID 23391351.
- ↑ Garland, S. M.; Skinner, S. R.; Brotherton, J. M. (2011). "Adolescent and young adult HPV vaccination in Australia: Achievements and challenges". Preventive Medicine. 53 Suppl 1: S29–35. doi:10.1016/j.ypmed.2011.08.015. PMID 21962468.
- ↑ ۳۰٫۰ ۳۰٫۱ ۳۰٫۲ ۳۰٫۳ ۳۰٫۴ ۳۰٫۵ Rodpothong, P; Auewarakul, P (2012). "Viral evolution and transmission effectiveness". World Journal of Virology. 1 (5): 131–34. doi:10.5501/wjv.v1.i5.131. PMC 3782273. PMID 24175217.
- ↑ Corti, D; Lanzavecchia, A (2013). "Broadly neutralizing antiviral antibodies". Annual Review of Immunology. 31: 705–42. doi:10.1146/annurev-immunol-032712-095916. PMID 23330954.
- ↑ ۳۲٫۰ ۳۲٫۱ Bull, R. A.; White, P. A. (2011). "Mechanisms of GII.4 norovirus evolution". Trends in Microbiology. 19 (5): 233–40. doi:10.1016/j.tim.2011.01.002. PMID 21310617.
- ↑ Ramani, S; Atmar, R. L.; Estes, M. K. (2014). "Epidemiology of human noroviruses and updates on vaccine development". Current Opinion in Gastroenterology. 30 (1): 25–33. doi:10.1097/MOG.0000000000000022. PMC 3955997. PMID 24232370.
- ↑ Pleschka, S (2013). "Overview of Influenza Viruses". Swine Influenza. Current Topics in Microbiology and Immunology. Vol. 370. pp. 1–20. doi:10.1007/82_2012_272. ISBN 978-3-642-36870-7. PMID 23124938.
- ↑ Han, T; Marasco, W. A. (2011). "Structural basis of influenza virus neutralization". Annals of the New York Academy of Sciences. 1217: 178–90. doi:10.1111/j.1749-6632.2010.05829.x. PMC 3062959. PMID 21251008.
- ↑ Reperant, L. A.; Rimmelzwaan, G. F.; Osterhaus, A. D. (2014). "Advances in influenza vaccination". F1000Prime Reports. 6: 47. doi:10.12703/p6-47. PMC 4047948. PMID 24991424.
- ↑ Weinberger, D. M.; Malley, R; Lipsitch, M (2011). "Serotype replacement in disease after pneumococcal vaccination". The Lancet. 378 (9807): 1962–73. doi:10.1016/S0140-6736(10)62225-8. PMC 3256741. PMID 21492929.
- ↑ ۳۸٫۰ ۳۸٫۱ McEllistrem, M. C.; Nahm, M. H. (2012). "Novel pneumococcal serotypes 6C and 6D: Anomaly or harbinger". Clinical Infectious Diseases. 55 (10): 1379–86. doi:10.1093/cid/cis691. PMC 3478140. PMID 22903767.
- ↑ Dagan, R (2009). "Impact of pneumococcal conjugate vaccine on infections caused by antibiotic-resistant Streptococcus pneumoniae". Clinical Microbiology and Infection. 15 Suppl 3: 16–20. doi:10.1111/j.1469-0691.2009.02726.x. PMID 19366365.
- ↑ Njeumi, F; Taylor, W; Diallo, A; Miyagishima, K; Pastoret, P. P.; Vallat, B; Traore, M (2012). "The long journey: A brief review of the eradication of rinderpest". Revue Scientifique et Technique (International Office of Epizootics). 31 (3): 729–46. PMID 23520729.
- ↑ Smith, K. A. (2013). "Smallpox: Can we still learn from the journey to eradication?". The Indian Journal of Medical Research. 137 (5): 895–99. PMC 3734679. PMID 23760373.
- ↑ ۴۲٫۰ ۴۲٫۱ ۴۲٫۲ ۴۲٫۳ Perisic, A; Bauch, C. T. (2009). "Social contact networks and disease eradicability under voluntary vaccination". PLoS Computational Biology. 5 (2): e1000280. doi:10.1371/journal.pcbi.1000280. PMC 2625434. PMID 19197342.
- ↑ ۴۳٫۰ ۴۳٫۱ ۴۳٫۲ Fu, F; Rosenbloom, D. I.; Wang, L; Nowak, M. A. (2011). "Imitation dynamics of vaccination behaviour on social networks" (PDF). Proceedings of the Royal Society B: Biological Sciences. 278 (1702): 42–49. doi:10.1098/rspb.2010.1107. PMC 2992723. PMID 20667876.
- ↑ Wicker, S; Maltezou, H. C. (2014). "Vaccine-preventable diseases in Europe: Where do we stand?". Expert Review of Vaccines. 13 (8): 979–87. doi:10.1586/14760584.2014.933077. PMID 24958075.
- ↑ ۴۵٫۰ ۴۵٫۱ Fukuda, E.; Tanimoto, J. (2014). Impact of Stubborn Individuals on a Spread of Infectious Disease under Voluntary Vaccination Policy. Springer. pp. 1–10. ISBN 978-3-319-13359-1. Retrieved 30 March 2015.
- ↑ Barrett, Scott (2014). "Global Public Goods and International Development". In J. Warren Evans, Robin Davies (ed.). Too Global To Fail: The World Bank at the Intersection of National and Global Public Policy in 2025. World Bank Publications. pp. 13–18. ISBN 978-1-4648-0310-9.
- ↑ Ozawa, S; Stack, M. L. (2013). "Public trust and vaccine acceptance – international perspectives". Human Vaccines & Immunotherapeutics. 9 (8): 1774–78. doi:10.4161/hv.24961. PMC 3906280. PMID 23733039.
- ↑ Parker, A. M.; Vardavas, R; Marcum, C. S.; Gidengil, C. A. (2013). "Conscious consideration of herd immunity in influenza vaccination decisions". American Journal of Preventive Medicine. 45 (1): 118–21. doi:10.1016/j.amepre.2013.02.016. PMC 3694502. PMID 23790997.
- ↑ Gowda, C; Dempsey, A. F. (2013). "The rise (and fall?) of parental vaccine hesitancy". Human Vaccines & Immunotherapeutics. 9 (8): 1755–62. doi:10.4161/hv.25085. PMC 3906278. PMID 23744504.
- ↑ Unless noted, R0 values are from: History and Epidemiology of Global Smallpox Eradication بایگانیشده در ۲۰۱۷-۰۳-۱۷ توسط Wayback Machine From the training course titled "Smallpox: Disease, Prevention, and Intervention". The Centers for Disease Control and Prevention and the World Health Organization. Slide 17. Retrieved 13 March 2015.
- ↑ Biggerstaff, M; Cauchemez, S; Reed, C; Gambhir, M; Finelli, L (2014). "Estimates of the reproduction number for seasonal, pandemic, and zoonotic influenza: A systematic review of the literature". BMC Infectious Diseases. 14: 480. doi:10.1186/1471-2334-14-480. PMC 4169819. PMID 25186370.
- ↑ Wallinga, J; Teunis, P (2004). "Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures". American Journal of Epidemiology. 160 (6): 509–16. doi:10.1093/aje/kwh255. PMID 15353409.
- ↑ Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. (January 2020). "Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia". The New England Journal of Medicine. doi:10.1056/NEJMoa2001316. PMID 31995857.
- ↑ Riou J, Althaus CL (January 2020). "Pattern of early human-to-human transmission of Wuhan 2019 novel coronavirus (2019-nCoV), December 2019 to January 2020". Euro Surveillance. 25 (4). doi:10.2807/1560-7917.ES.2020.25.4.2000058. PMC 7001239. PMID 32019669.
- ↑ Althaus, C. L. (2014). "Estimating the Reproduction Number of Ebola Virus (EBOV) During the 2014 Outbreak in West Africa". PLoS Currents. 6. doi:10.1371/currents.outbreaks.91afb5e0f279e7f29e7056095255b288. PMC 4169395. PMID 25642364.
- ↑ Dabbaghian, V.; Mago, V. K. (2013). Theories and Simulations of Complex Social Systems. Springer. pp. 134–35. ISBN 978-3-642-39149-1. Retrieved 29 March 2015.
- ↑ Strassburg, M. A. (1982). "The global eradication of smallpox". American Journal of Infection Control. 10 (2): 53–59. doi:10.1016/0196-6553(82)90003-7. PMID 7044193.
- ↑ Rashid, H; Khandaker, G; Booy, R (2012). "Vaccination and herd immunity: What more do we know?". Current Opinion in Infectious Diseases. 25 (3): 243–49. doi:10.1097/QCO.0b013e328352f727. PMID 22561998.
پیوند به بیرون
[ویرایش]- Topley, W. W. C.; Wilson, G. S. (May 1923). "The Spread of Bacterial Infection. The Problem of Herd-Immunity". The Journal of Hygiene. 21 (3): 243–49. doi:10.1017/s0022172400031478. PMC 2167341. PMID 20474777.
- شبیهسازی بصری از ایمنی گله توسط شین کیلیان نوشته شده و توسط رابرت وب اصلاح شدهاست