Diboraani
| Diboraani | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| Ominaisuudet | |
| Molekyylikaava | B2H6 |
| Moolimassa | 27,668 g/mol |
| Ulkomuoto | Väritön kaasu |
| Sulamispiste | –165 °C[1] |
| Kiehumispiste | –92 °C |
| Tiheys | 0,96 g/cm3 |
| Liukoisuus veteen | Reagoi veden kanssa |
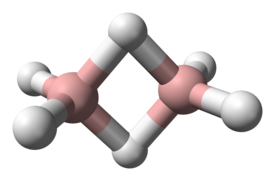
Diboraani (B2H6) on boorin ja vedyn muodostama molekyyliyhdiste. Ainetta käytetään muun muassa orgaanisessa kemiassa uusien yhdisteiden synteesissä.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]Huoneenlämpötilassa diboraani on herkästi syttyvää makeantuoksuista kaasua. Aine polymerisoituu suhteellisen helposti, jolloin syntyy pentaboraania. Veden kanssa kosketukseen joutuessaan aine hajoaa muodostaen boorihappoa ja vetyä.[1]
Valmistus
[muokkaa | muokkaa wikitekstiä]Diboraania voidaan valmistaa useilla eri tavoilla. Ensimmäinen diboraanin synteesi perustui magnesiumdiboridin hajottamiseen. Myöhemmin ainetta syntetisoitiin sähköpurkauksien avulla boorihalideista ja vedystä. Näiden reaktioiden tuotto oli kuitenkin alle 10 %.[2]
Nykyään diboraania syntetisoidaan alkalimetallihydrideistä, kuten litiumhydridistä, ja booritrifluoridista. Tuotteena syntyy lisäksi litiumfluoridia.[2]
- 6LiH + 2BF3 → B2H6 + 6LiF
Valmistuksessa voidaan käyttää myös natriumborohydridiä[3] tai litiumalumiinihydridiä.[4]
Käyttö
[muokkaa | muokkaa wikitekstiä]Diboraania käytetään hiilivetyjen hydroboraatio-oksidaatiossa, jossa boraani liittyy hiilivetyyn. Boraani on kuitenkin hyvin epästabiili aine. Diboraanin eetteriliuos onkin korvannut pelkän boraanin. Usein käytetään diboraanin tetrahydrofuraaniliuosta.[5]
Muita diboraanin käyttökohteita ovat rakettien polttoaineet, muiden niin sanottujen korkeampien boraanien valmistus ja polymeraatioreaktioiden katalyyttinä toimiminen. Ainetta voidaan myös käyttää pelkistimenä orgaanisissa synteeseissä.[6]
Turvallisuus
[muokkaa | muokkaa wikitekstiä]Diboraani on myrkyllinen kaasu. Aineen joutumisesta hengitysteihin seurauksena on pahoinvointia, hengenahdistusta sekä ruumiin lämpötilan kohoamista. Pitkäaikainen altistus voi johtaa keuhkopöhöön.[1]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c Diboraanin kansainvälinen kemikaalikortti Viitattu 28.1.2009
- ↑ a b V. I. Mikheeva & E. M. Fedneva: Reaction between the ether complex of boron trifluoride and lithium hydride Communication 1. Preparation of pure diborane. Russian Chemical Bulletin, 1956, Volume 5. vsk, nro Number 8 / August, 1956. ISSN 1573-9171 Artikkelin verkkoversio. Viitattu 28.1.2009. (englanniksi)
- ↑ Sheldon G. Shore & Mark A. Toft: Dry process for producing diborane KreePatentsOnline. Viitattu 28.1.2009. (englanniksi)
- ↑ I. Shapiro, H. G. Weiss, M. Schmich, Sol Skolnik, G.B. L. Smith: Preparation of Diborane by the Lithium Aluminum Hydride—Boron Trifluoride Reaction J. Am. Chem. Soc., 1952, 74 (4), pp 901–905. ACS Publications. Viitattu 28.1.2009. (englanniksi)
- ↑ Hydroboration of Alkenes ChemgaPedia. Viitattu 28.1.2009. (englanniksi)
- ↑ Boron hydrides (or boranes) TutorVista.com. Arkistoitu 21.2.2009. Viitattu 28.1.2009. (englanniksi)
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Diboraanin käyttöturvallisuustiedote, Sigma Aldrich, viitattu 18.1.2015.
- Molecule of the Month: Diborane. Bristol University School of Chemistry. (englanniksi)

