Fluorure de vanadium(III)
| Fluorure de vanadium (III) | |
| |
| __ V3+ __ F− | |
| Identification | |
|---|---|
| Synonymes |
trifluorure de vanadium |
| No CAS | |
| No ECHA | 100.030.141 |
| PubChem | 66230 |
| SMILES | |
| InChI | |
| Apparence | poudre jaune-vert (anhydre) poudre verte(trihydrate)[1],[2] |
| Propriétés chimiques | |
| Formule | VF3 |
| Masse molaire[3] | 107,936 7 ± 0,000 1 g/mol F 52,8 %, V 47,2 %, |
| Propriétés physiques | |
| T° fusion | 800 °C[2] |
| T° ébullition | 1 395 °C à 760 mmHg (anhydre)[1] 1 400 °C[2] |
| Solubilité | insol. in eau et éthanol[1] |
| Masse volumique | 3,363 g·cm-3[1] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | (no 167) [4] |
| Précautions | |
| SGH[5] | |
| H301, H311, H314, H331, P261, P280, P310, P301+P310 et P305+P351+P338 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le fluorure de vanadium (III) est un composé chimique de formule VF3. Ce solide vert-jaune est obtenue en deux étapes de synthèse à partir de l'oxyde de vanadium V2O3[6]. Comme les autres fluorures de métaux de transition (par exemple le fluorure de manganèse), il possède un ordre magnétique[Lequel ?] à basse température (par exemple, pour V2F6.4H2O la température critique est 12 K[7].
Préparation
[modifier | modifier le code]Dans une première étape, de l'hexafluorovanadate (III) d'ammonium est formé à partir d'oxyde de vanadium et de difluorure d'ammonium :
- V2O3 + 6 (NH4)HF2 → 2 (NH4)3VF6 + 3 H2O
Dans une seconde étape, l'hexafluorovanadate (III) d'ammonium est chauffé et se décompose comme suit :
- (NH4)3VF6 → 3 NH3 + 3 HF + VF3
La décomposition thermique des sels d'ammonium est une méthode assez commune pour générer des composés inorganiques.
VF3 peut également être formé par action de HF sur V2O3.
Propriétés
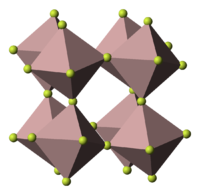
[modifier | modifier le code]VF3 est un solide cristallin dans lequel les atomes de vanadium ont une coordinence de 6 et sont liés les uns aux autres par des atomes de fluor. L’existence d’un moment magnétique indique la présence d’électrons non appariés.
Structure
[modifier | modifier le code]Le fluorure de vanadium (III) cristallise dans le système rhomboédrique (trigonal), groupe d'espace associé R3c (no 167) issu du groupe ponctuel 3 2/m avec comme paramètres de maille a = 517 pm, c = 1340,2 pm et α = β = 90°, γ = 120°[4].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Vanadium(III) fluoride » (voir la liste des auteurs).
- David R. Lide, CRC Handbook of Chemistry and Physics,90e ed., 2009, Boca Raton, Florida: CRC Press. (ISBN 978-1-4200-9084-0).
- Vanadium trifluoride sur webelements.com, consulté le 30/04/2017.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, New York, 2007, Springer Science+Business Media, Inc., p. 102. (ISBN 0-387-26147-8).
- Fiche Sigma-Aldrich du composé Vanadium(III) fluoride, consultée le 25 avril 2011. + (pdf) Fiche MSDS
- B. J. Sturm, C. W. Sheridan, Vanadium(III) Fluoride, Inorganic Syntheses, 1963, vol. 7, pp. 52-54.
- S. Nakhal et al., Z. Kristallogr., 2013, vol. 228, p. 347. DOI 10.1524/zkri.2013.1664.

