« Lemborexant » : différence entre les versions
Aucun résumé des modifications |
mAucun résumé des modifications |
||
| (7 versions intermédiaires par 6 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{orphelin|date=février 2024}} |
|||
{{Infobox Médicament |
{{Infobox Médicament |
||
| Ligne 8 : | Ligne 9 : | ||
<!--Identifiers-->}} |
<!--Identifiers-->}} |
||
Le '''lemborexant''', commercialisé sous la marque '''Dayvigo''', est un médicament |
Le '''lemborexant''', commercialisé sous la marque '''Dayvigo''', est un médicament antagoniste de l'[[orexine]] utilisé dans le traitement de l'[[insomnie]]<ref name="pmid34078141">{{Article|titre=Review of the Efficacy and Safety of Lemborexant, a Dual Receptor Orexin Antagonist (DORA), in the Treatment of Adults With Insomnia Disorder|périodique=The Annals of Pharmacotherapy|volume=56|numéro=2|pages=213–221|date=February 2022|pmid=34078141|doi=10.1177/10600280211008492|s2cid=235321467}}</ref>. Il est indiqué spécifiquement dans le traitement de l'insomnie caractérisée par des difficultés de début du sommeil ou de maintien du sommeil chez l'adulte<ref name="pmid34078141" />. Le médicament est pris par [[voie orale]]<ref name="pmid34078141" />. |
||
Les [[Effet secondaire (médecine)|effets secondaires]] du lemborexant comprennent la [[Sommeil#Somnolence|somnolence]], |
Les [[Effet secondaire (médecine)|effets secondaires]] du lemborexant comprennent la [[Sommeil#Somnolence|somnolence]], la [[Fatigue (physiologie)|fatigue]], les [[Céphalée|maux de tête]] et les [[Rêve|rêves anormaux]]<ref name="pmid34078141" />. Le médicament est un [[antagoniste double des récepteurs de l'orexine]] (DORA)<ref name="pmid34078141" />. Il agit comme un double [[Antagoniste (biochimie)|antagoniste]] [[Sélectivité de liaison|sélectif]] des [[Récepteur de l'hypocrétine|récepteurs de l'orexine]] [[HCRTR1|OX <sub>1</sub>]] et [[HCRTR2|OX <sub>2</sub>]]<ref name="pmid34078141" />. Le lemborexant a une longue [[Période biologique|demi-vie d'élimination]] de 17 à 55{{Spaces}}heures et un [[Tmax (pharmacologie)|temps de pointe]] d'environ 1 à 3{{Spaces}}heures<ref name="pmid34078141" />. Ce n'est pas une [[benzodiazépine]] ou un [[Non-benzodiazépine|médicament Z]] et n'interagit pas avec les [[récepteur GABAA|récepteurs GABA]], mais a plutôt un [[mécanisme d'action]] distinct<ref name="pmid34078141" />. |
||
Le lemborexant a été approuvé pour un usage médical aux États-Unis en décembre 2019 |
Le lemborexant a été approuvé pour un usage médical aux États-Unis en décembre 2019<ref>{{Lien web |titre=Novel Drug Approvals for 2019 |url=http://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2019 |série=U.S. [[Food and Drug Administration]] (FDA) |date=2 January 2020 |consulté le=10 January 2020}}</ref>{{,}}<ref>{{Lien web |titre=FDA-Approved Drugs: Lemborexant |url=https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=212028 |série=U.S. [[Food and Drug Administration]] (FDA) |consulté le=10 January 2020}}</ref>{{,}}<ref name="Approval">{{Lien web |titre=FDA Approves Dayvigo (lemborexant) for the Treatment of Insomnia in Adult Patients |url=https://www.drugs.com/newdrugs/fda-approves-dayvigo-lemborexant-insomnia-adult-patients-5132.html |série=Drugs.com |date=23 December 2019 |consulté le=10 January 2020}}</ref>. Il s'agit d'une [[substance contrôlée]] du [[Controlled Substances Act|tableau IV]] aux États-Unis et son [[Abus de substances|potentiel d'abus]] est faible<ref name="pmid34078141" />. Outre le lemborexant, d'autres antagonistes des récepteurs de l'orexine, notamment le [[suvorexant]] et le [[Daridorexant]], ont également été introduits<ref name="pmid35043499">{{Article|titre=Hypocretins (orexins): The ultimate translational neuropeptides|périodique=Journal of Internal Medicine|volume=291|numéro=5|pages=533–556|date=May 2022|pmid=35043499|doi=10.1111/joim.13406|s2cid=248119793}}</ref>{{,}}<ref name="pmid35298826">{{Article|titre=Daridorexant: First Approval|périodique=Drugs|volume=82|numéro=5|pages=601–607|date=April 2022|pmid=35298826|pmcid=9042981|doi=10.1007/s40265-022-01699-y}}</ref>. Le composé fait l'objet des essais cliniques en [[Europe]], mais n'est pas autorisé pour la commercialisation au continent <ref> {{Lien web |langue=anglais |titre=Clinical Trial Results: |
||
A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group Study with Open-Label Extension Phase of the Efficacy and Safety of Lemborexant in Subjects with Irregular Sleep-Wake Rhythm Disorder and Mild to Moderate Alzheimer’s Disease Dementia |url= https://www.clinicaltrialsregister.eu/ctr-search/trial/2017-003306-40/results|date=2023|site=clinicaltrialsregister.eu |consulté le=16 février 2024}}</ref>. |
A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group Study with Open-Label Extension Phase of the Efficacy and Safety of Lemborexant in Subjects with Irregular Sleep-Wake Rhythm Disorder and Mild to Moderate Alzheimer’s Disease Dementia |url= https://www.clinicaltrialsregister.eu/ctr-search/trial/2017-003306-40/results|date=2023|site=clinicaltrialsregister.eu |consulté le=16 février 2024}}</ref>. |
||
== Références == |
== Références == |
||
{{Références}} |
{{Références}} |
||
{{Portail|pharmacie}} |
|||
[[Catégorie:Pyrimidine]] |
[[Catégorie:Pyrimidine]] |
||
[[Catégorie:Composé organofluoré]] |
[[Catégorie:Composé organofluoré]] |
||
Dernière version du 11 mars 2024 à 21:17
| Lemborexant | |
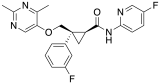
| |
| Informations générales | |
|---|---|
| Princeps | Dayvigo |
| Données pharmacocinétiques | |
| Métabolite(s) | M10[1]. |
| Excrétion | |
| Identification | |
| No CAS | |
| DrugBank | DB11951 |
| modifier |
|
Le lemborexant, commercialisé sous la marque Dayvigo, est un médicament antagoniste de l'orexine utilisé dans le traitement de l'insomnie[2]. Il est indiqué spécifiquement dans le traitement de l'insomnie caractérisée par des difficultés de début du sommeil ou de maintien du sommeil chez l'adulte[2]. Le médicament est pris par voie orale[2].
Les effets secondaires du lemborexant comprennent la somnolence, la fatigue, les maux de tête et les rêves anormaux[2]. Le médicament est un antagoniste double des récepteurs de l'orexine (DORA)[2]. Il agit comme un double antagoniste sélectif des récepteurs de l'orexine OX 1 et OX 2[2]. Le lemborexant a une longue demi-vie d'élimination de 17 à 55 heures et un temps de pointe d'environ 1 à 3 heures[2]. Ce n'est pas une benzodiazépine ou un médicament Z et n'interagit pas avec les récepteurs GABA, mais a plutôt un mécanisme d'action distinct[2].
Le lemborexant a été approuvé pour un usage médical aux États-Unis en décembre 2019[3],[4],[5]. Il s'agit d'une substance contrôlée du tableau IV aux États-Unis et son potentiel d'abus est faible[2]. Outre le lemborexant, d'autres antagonistes des récepteurs de l'orexine, notamment le suvorexant et le Daridorexant, ont également été introduits[6],[7]. Le composé fait l'objet des essais cliniques en Europe, mais n'est pas autorisé pour la commercialisation au continent [8].
Références
[modifier | modifier le code]- (en) « Monographe FDA du composé », sur FDA.gov, (consulté le )
- « Review of the Efficacy and Safety of Lemborexant, a Dual Receptor Orexin Antagonist (DORA), in the Treatment of Adults With Insomnia Disorder », The Annals of Pharmacotherapy, vol. 56, no 2, , p. 213–221 (PMID 34078141, DOI 10.1177/10600280211008492, S2CID 235321467)
- « Novel Drug Approvals for 2019 », U.S. Food and Drug Administration (FDA), (consulté le )
- « FDA-Approved Drugs: Lemborexant », U.S. Food and Drug Administration (FDA) (consulté le )
- « FDA Approves Dayvigo (lemborexant) for the Treatment of Insomnia in Adult Patients », Drugs.com, (consulté le )
- « Hypocretins (orexins): The ultimate translational neuropeptides », Journal of Internal Medicine, vol. 291, no 5, , p. 533–556 (PMID 35043499, DOI 10.1111/joim.13406, S2CID 248119793)
- « Daridorexant: First Approval », Drugs, vol. 82, no 5, , p. 601–607 (PMID 35298826, PMCID 9042981, DOI 10.1007/s40265-022-01699-y)
- (en) « Clinical Trial Results: A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group Study with Open-Label Extension Phase of the Efficacy and Safety of Lemborexant in Subjects with Irregular Sleep-Wake Rhythm Disorder and Mild to Moderate Alzheimer’s Disease Dementia », sur clinicaltrialsregister.eu, (consulté le )
