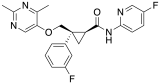
Lemborexant
| Lemborexant | |
| |
| Informations générales | |
|---|---|
| Princeps | Dayvigo |
| Données pharmacocinétiques | |
| Métabolite(s) | M10[1]. |
| Excrétion | |
| Identification | |
| No CAS | |
| DrugBank | DB11951 |
| modifier |
|
Le lemborexant, commercialisé sous la marque Dayvigo, est un médicament antagoniste de l'orexine utilisé dans le traitement de l'insomnie . [2] Il est indiqué spécifiquement dans le traitement de l'insomnie caractérisée par des difficultés de début du sommeil ou de maintien du sommeil chez l'adulte. [2] Le médicament est pris par voie orale . [2]
Les effets secondaires du lemborexant comprennent la somnolence, la fatigue, les maux de tête et les rêves anormaux . [2] Le médicament est un antagoniste double des récepteurs de l'orexine (DORA). [2] Il agit comme un double antagoniste sélectif des récepteurs de l'orexine OX 1 et OX 2 . [2] Le lemborexant a une longue demi-vie d'élimination de 17 à 55 heures et un temps de pointe d'environ 1 à 3 heures. [2] Ce n'est pas une benzodiazépine ou un médicament Z et n'interagit pas avec les récepteurs GABA, mais a plutôt un mécanisme d'action distinct. [2]
Le lemborexant a été approuvé pour un usage médical aux États-Unis en décembre 2019. [3] [4] [5] Il s'agit d'une substance contrôlée du tableau IV aux États-Unis et son potentiel d'abus est faible. [2] Outre le lemborexant, d'autres antagonistes des récepteurs de l'orexine, notamment le suvorexant et le daridorexant, ont également été introduits. [6] [7] Le composé fait l'objet des essais cliniques en Europe, mais n'est pas autorisé pour la commercialisation au continent [8].
Références
- (en) « Monographe FDA du composé », sur FDA.gov, (consulté le )
- « Review of the Efficacy and Safety of Lemborexant, a Dual Receptor Orexin Antagonist (DORA), in the Treatment of Adults With Insomnia Disorder », The Annals of Pharmacotherapy, vol. 56, no 2, , p. 213–221 (PMID 34078141, DOI 10.1177/10600280211008492, S2CID 235321467) Erreur de référence : Balise
<ref>incorrecte : le nom « pmid34078141 » est défini plusieurs fois avec des contenus différents. - « Novel Drug Approvals for 2019 », U.S. Food and Drug Administration (FDA), (consulté le )
- « FDA-Approved Drugs: Lemborexant », U.S. Food and Drug Administration (FDA) (consulté le )
- « FDA Approves Dayvigo (lemborexant) for the Treatment of Insomnia in Adult Patients », Drugs.com, (consulté le )
- « Hypocretins (orexins): The ultimate translational neuropeptides », Journal of Internal Medicine, vol. 291, no 5, , p. 533–556 (PMID 35043499, DOI 10.1111/joim.13406, S2CID 248119793)
- « Daridorexant: First Approval », Drugs, vol. 82, no 5, , p. 601–607 (PMID 35298826, PMCID 9042981, DOI 10.1007/s40265-022-01699-y)
- (en) « Clinical Trial Results: A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group Study with Open-Label Extension Phase of the Efficacy and Safety of Lemborexant in Subjects with Irregular Sleep-Wake Rhythm Disorder and Mild to Moderate Alzheimer’s Disease Dementia », sur clinicaltrialsregister.eu, (consulté le )