Nukleofil
A nukleofil olyan részecske, amely mindkét szükséges elektront biztosítja reakciópartnerének a kettejük közötti kötés kialakításához. Minden molekula és ion, melyben szabad elektronpár vagy legalább egy pi-kötés található, viselkedhet nukleofilként. Mivel a nukleofilek elektronpárt adnak át, definíció szerint Lewis-bázisok. A nukleofil reakciópartnere az elektrofil.[1]
A nukleofil kifejezés jelzőként a nukleofil atommaghoz való affinitását írja le. A nukleofilitás, vagy ritkább szóhasználattal nukleofil erősség egy anyag nukleofil jellegére utal, melyet gyakran használnak az atomok affinitásának összehasonlítására.
Az oldószerekkel, például alkoholokkal vagy vízzel lejátszódó semleges nukleofil reakciókat szolvolízisnek nevezik. A nukleofilek részt vehetnek nukleofil szubsztitúciós reakcióban is, amikor a nukleofil (részleges) pozitív töltéshez vonzódik.
Elnevezése
[szerkesztés]A nukleofil és elektrofil kifejezéseket Christopher Kelk Ingold vezette be 1929-ben,[2] helyettesítendő a korábban A. J. Lapworth által 1925-ben javasolt anionoid és kationoid elnevezéseket.[3]
A nukleofil szó az atommag (nukleusz) és a görög φιλος (philos, kedvel) szavakból származik.
Tulajdonságok
[szerkesztés]A periódusos rendszerben egy csoporton belül minél bázikusabb egy ion (minél nagyobb a konjugált sav pKa-ja), annál reaktívabb nukleofil. Egy adott csoporton belül a nukleofil erősségben a polarizálhatóság játszik nagyobb szerepet: minél könnyebb deformálni egy atom vagy molekula körül az elektronfelhőt, annál könnyebben lép reakcióba. A jodidion (I−) például erősebb nukleofil, mint a fluoridion (F−).
Nukleofil erősség
[szerkesztés]Számos módszert javasoltak a nukleofilek relatív erősségének jellemzésére. A következő kísérleti adatokat számos nukleofil és elektrofil közötti reakció sebességének mérésével kapták. Az úgynevezett alfa-effektust mutató nukleofileket rendszerint kihagyják az ilyen adatok feldolgozásából.
Swain–Scott-egyenlet
[szerkesztés]Az első kísérlet az 1953-ban felírt Swain–Scott-egyenlet:[4][5]
Ez a szabadentalpia összefüggés egy reakció (25 °C-on vízben mért) k pszeudo elsőrendű reakciósebességi együtthatójának egy standard reakcióra – melyben víz a nukleofil – normalizált k0 sebességi együtthatója, valamint az adott nukleofilre jellemző n nukleofil konstans és az s szubsztrát konstans között teremt kapcsolatot, utóbbi számértéke a szubsztrát nukleofil támadással szembeni érzékenységétől függ (a metil-bromid esetén értéke definíció szerint 1).
Ezzel az eljárással a tipikus nukleofil anionokra az alábbi értékek adódnak: acetát 2,7; klorid 3,0; azid 4,0; hidroxidion 4,2; anilin 4,5; jodid 5,0 és tioszulfát 6,4. Jellemző szubsztrát állandók: etil-tozilát 0,66; β-propiolakton 0,77; 2,3-epoxipropanol 1,00; benzil-klorid 0,87 és benzoil-klorid 1,43.
Az egyenlet alapján a benzil-klorid nukleofil reakcióban 3000-szer gyorsabban reagál azidionnal, mint vízzel.
Ritchie-egyenlet
[szerkesztés]Másik szabadentalpia összefüggés az 1972-es Ritchie-egyenlet:[6][7][8]
ahol N+ a nukeofiltől függő paraméter és k0 a vízzel mért reakciósebességi együttható. Ebben az egyenletben nincs a szubsztráttól függő paraméter, mint amilyen a Swain–Scott-egyenletben az s tag. Az egyenlet szerint két nukleofil az elektrofil természetétől függetlenül azonos relatív reaktivitással reagál, ami ellentmond a reaktivitási-szelektivitási elvnek. Emiatt ezt az egyenletet állandó szelektivitású összefüggésnek is nevezik.
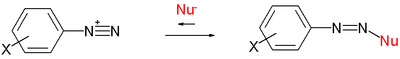
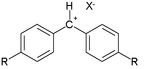
Az eredeti publikációban az adatokat válogatott nukleofilek és válogatott elektrofil karbokationok – például tropilium vagy diazónium kationok – közötti reakcióval nyerték:
vagy (az itt nem ábrázolt) malachitzöld ionján alapulva. Azóta számos más reakciótípust is leírtak.
Az N+ jellemző Ritchie értékei (metanolban) a következők: metanol 0,5; cianid anion 5,9; metoxid anion 7,5; azid anion 8,5 és tiofenol anion 10,7. A kationok relatív reakciókészségének értékei: malachitzöld kation −0,4; benzoldiazónium kation +2,6 és tropilium kation +4,5.
Mayr–Patz-egyenlet
[szerkesztés]A Mayr–Patz-egyenlet (1994):[9]
Egy reakció 20 °C-on mért k másodrendű reakciósebességi együtthatóját kapcsolja össze az N nukleofilicitási, az E elektrofilicitási, valamint egy, a nukleofiltől függő s meredekség paraméterrel. Az s állandó értéke 2-metil-1-pentén nukleofil esetén 1.
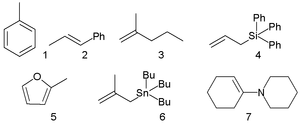
Számos állandót az úgynevezett benzhidríliumion elektrofillel végzett reakció alapján határoztak meg:[10]
melyekben különböző π-nukleofileket használtak:
E jellemző értékei: +6,2 ha R = klór, +5,90 ha R = hidrogén, 0 ha R = metoxi és -7,02 ha R = dimetilamin.
N jellemző értékei (mellette zárójelben s): -4,47 (1,32) a toluolra történő aromás elektrofil szubsztitúció esetén (1), -0,41 (1,12) az 1-fenil-2-propénre (2) történő és 0,96 (1) a 2-metil-1-penténre (3) történő elektrofil addíció esetén, -0,13 (1,21) a trifenilallilszilán (4) reakciójában, 3,61 (1,11) a 2-metilfurán (5) reakciójában, +7,48 (0,89) az izobutenil-tributilsztannán (6) és +13,36 (0,81) az enamin 7 reakciójában.[11]
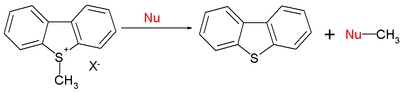
A szerves reakciók köre az SN2 reakciókat is magában foglalja:[12]
Az S-metildibenzotioféniumion E = -9,15 értéke mellett a nukleofilekre jellemző jellemző N (s) értékek az alábbiak: 15,63 (0,64) piperidin, 10,49 (0,68) metoxid és 5,20 (0,89) víz esetén. Összefoglalva, az sp2 vagy sp3 centrumokkal szembeni nukleofilitás ugyanazt a trendet követi.
Egyesített egyenlet
[szerkesztés]A fenti egyenletek egyesítési kísérleteként a Mayr-egyenletet az alábbi formában írható fel:[12]
ahol sE az elektrofilre, sN a nuklefilre jellemző paraméter. Ezt az egyenletet többféle módon is át lehet írni:
- ha karbokationokra sE = 1 értéket választunk, akkor az 1994-es Mayr–Patz-egyenletet kapjuk,
- ha a legtöbb n nukleofilre sN = 0,6 értéket tételezünk fel, az egyenlet formája az alábbi lesz:
- mely megfelel az eredeti Scott–Swain-egyenlet alábbi felírásának:
- karbokationokra sE = 1 és sN = 0,6 értékekkel az egyenlet így alakul:
- mely az eredeti Ritchie-egyenlet átírva az alábbi formába:
Nukleofilek típusai
[szerkesztés]Nukleofilek például az anionok, mint a Cl−, vagy a nemkötő elektronpárral rendelkező vegyületek, mint az NH3 (ammónia).
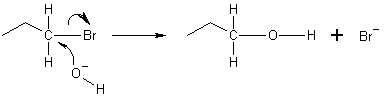
Az alábbi példában a hidroxidion oxigénatomja elektronpár donálásával kötést alakít ki a brómpropán molekula végén található szénatommal. Ezután a szén- és brómatom közötti kötés heterolitikusan felhasad, a brómatom – Br− bromidionná alakulva – magával viszi a donált elektront, mivel az SN2 reakció hátoldali támadással megy végbe. Ez azt jelenti, hogy a hidroxidion a szénatomot az ellenkező oldalról támadja meg, pontosan a brómatommal átellenes irányból. Emiatt a hátoldali támadás miatt az SN2 reakció az elektrofil konfigurációjának megváltozásával jár. Amennyiben az elektrofil királis, akkor általában királis is marad, de az SN2 termék konfigurációja az eredeti elektrofiléhez képest ellenkezőjére fordul.
Az ambidentát nukleofil olyan részecske, amely két vagy több helyről is képes támadni, ezáltal két vagy több termék keletkezik. A tiocianátion (SCN−) például támadhat a kén vagy a nitrogén felőli végével is. Emiatt az alkil-halogenidek és SCN− SN2 reakciójában gyakran RSCN (alkil-tiocianát) és RNCS (alkil-izotiocianát) keveréke keletkezik. Hasonló megfontolások érvényesek a Kolbe-féle nitrilszintézisre is.
Szén
[szerkesztés]Szén nukleofilek az alkil-fém-halogenidek, melyek előfordulnak a Grignard-reakcióban, Blaise-reakcióban, Reformatsky-reakcióban és Barbier-reakcióban, valamint a lítiumorganikus reagensek és a láncvégi hármas kötést tartalmazó alkinek (terminális alkinek) anionjai.
Az enolok is szén nukleofilek. Az enolok képződését sav vagy bázis katalizálja. Az enolok ambidentát nukleofilek, de általában csak az alfa szénatomjuk reagál. Az enolokat gyakran használják kondenzációs reakciókban, például a Claisen-kondenzációs és az aldol kondenzációs reakciókban.
Oxigén
[szerkesztés]Oxigén nukleofilre példa a víz (H2O), hidroxid anion, alkoholok, alkoxid anionok, hidrogén-peroxid és karboxilát anionok. Nukleofil támadás nem megy végbe intermolekuláris hidrogénkötés jelenlétében.
Kén
[szerkesztés]A kén nukleofilek közül leggyakrabban a hidrogén-szulfid és sói, tiolok (RSH), tiolát anionok (RS−), tiokarbonsavak anionjai (RC(O)-S−) és ditiokarbonátok (RO-C(S)-S−), valamint ditiokarbamátok anionjai (R2N-C(S)-S−) használatosak.
A kén – nagy méretéből fakadó könnyű polarizálhatósága, valamint nemkötő elektronpárjainak könnyű hozzáférhetősége miatt – általában erős nukleofil.
Nitrogén
[szerkesztés]Nitrogén nukleofil többek között az ammónia, az azidion, az aminok és a nitritek.
Jegyzetek
[szerkesztés]- ↑ nucleophile (nucleophilic), A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ Ingold, C. K. Recl. TraV. Chim. Pays-Bas 1929
- ↑ Lapworth, A. Nature 1925, 115, 625
- ↑ Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides C. Gardner Swain, Carleton B. Scott J. Am. Chem. Soc.; 1953; 75(1); 141-147. Abstract
- ↑ Swain–Scott equation, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ Ritchie equation, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ Nucleophilic reactivities toward cations Calvin D. Ritchie Acc. Chem. Res.; 1972; 5(10); 348-354. Abstract
- ↑ Cation-anion combination reactions. XIII. Correlation of the reactions of nucleophiles with esters Calvin D. Ritchie J. Am. Chem. Soc.; 1975; 97(5); 1170–1179. Abstract
- ↑ Scales of Nucleophilicity and Electrophilicity: A System for Ordering Polar Organic and Organometallic Reactions Angewandte Chemie International Edition in English, Vol. 33, No. 9, P. 938-957 doi:10.1002/anie.199409381
- ↑ Reference Scales for the Characterization of Cationic Electrophiles and Neutral NucleophilesHerbert Mayr, Thorsten Bug, Matthias F. Gotta, Nicole Hering, Bernhard Irrgang, Brigitte Janker, Bernhard Kempf, Robert Loos, Armin R. Ofial, Grigoriy Remennikov, and Holger Schimmel J. Am. Chem. Soc.; 2001; 123(39) pp 9500 – 9512; (Article) doi:10.1021/ja010890y
- ↑ An internet database for reactivity parameters maintained by the Mayr group is available at http://www.cup.uni-muenchen.de/oc/mayr/
- ↑ a b Towards a General Scale of Nucleophilicity? Thanh Binh Phan, Martin Breugst, Herbert Mayr, Angewandte Chemie International Edition Volume 45, Issue 23 , Pages 3869 – 3874 2006 doi:10.1002/anie.200600542
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Nucleophile című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.