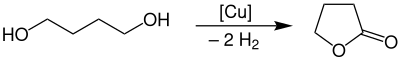Gamma-butirrolattone
| Gamma-butirrolattone | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H6O2 |
| Numero CAS | |
| Numero EINECS | 202-509-5 |
| PubChem | 7302 |
| DrugBank | DBDB04699 |
| SMILES | C1CC(=O)OC1 |
| Indicazioni di sicurezza | |
Il gamma-butirrolattone[1] (chiamato anche gamma-Butyrolactone[2][3], γ-Butirrolattone[4], GBL o butirrolattone) è un liquido igroscopico incolore e miscibile con acqua con un odore caratteristico. È il più semplice di lattoni a 4 atomi di carbonio.
Viene utilizzato principalmente come intermedio nella produzione di altri prodotti chimici, come ad esempio il 1-metil-2-pirrolidone[5]. Negli esseri umani il GBL agisce come profarmaco per l'acido γ-idrossibutirrico (GHB), con effetti simili ai barbiturici ed è classificato come stupefacente dalla legislazione italiana (dal D.M. 28 marzo 2002 del Ministero della Salute[6]).
Dove si trova
[modifica | modifica wikitesto]Il GBL è stato trovato in estratti di campioni di vini non adulterati.[7][8] Questa scoperta indica che il GBL è un componente naturale in alcuni vini e può essere presente in prodotti simili. La concentrazione rilevata era di circa 5 µg/mL ed è stata facilmente osservata utilizzando una semplice tecnica di estrazione seguita dall'analisi GC/MS. Il GBL può essere trovato negli aromi del formaggio ma in genere si traduce in un contenuto di 0,0002% GBL nel cibo finale.
Produzione e sintesi
[modifica | modifica wikitesto]Il γ-butirrolattone viene prodotto industrialmente mediante deidrogenazione dell'1,4-butandiolo a una temperatura di 180–300 °C e pressione atmosferica in presenza di un catalizzatore di rame.[9]
La resa di questo processo è di circa il 95%. La purificazione avviene con estrazione in fase liquido-gas.[9]
In laboratorio può essere ottenuto anche mediante ossidazione del tetraidrofurano (THF), ad esempio con bromato di sodio acquoso bromato di sodio.[10] Un percorso alternativo procede dal GABA tramite un sale di diazonio.[11]
Note
[modifica | modifica wikitesto]- ^ Gamma-idrossibutirrato (GHB), gamma-butirrolattone (GBL) 1,4-butandiolo (BD) (PDF), su newsd.admin.ch.
- ^ Lide, David R., 1928-, CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data, 90th ed. 2009-2010, CRC Press, 2009, ISBN 9781420090840, OCLC 406781123. URL consultato il 27 marzo 2019.
- ^ R L Maynard, The Merck Index: 12th edition 1996, in Occupational and Environmental Medicine, vol. 54, n. 4, 1º aprile 1997, pp. 288–288, DOI:10.1136/oem.54.4.288. URL consultato il 27 marzo 2019.
- ^ https://books.google.com.ua/books?id=PnGhBQAAQBAJ&pg=PA227&dq=γ-Butirrolattone&hl=it&sa=X&ved=0ahUKEwiyueT-yqHhAhUorVkKHWaSBzQQ6AEILzAB#v=onepage&q=γ-Butirrolattone&f=false
- ^ (EN) Wolfgang Schwarz, Jürgen Schossig e Roland Rossbacher, Ullmann's Encyclopedia of Industrial Chemistry, American Cancer Society, 2000, DOI:10.1002/14356007.a04_495, ISBN 9783527306732. URL consultato il 27 marzo 2019.
- ^ Testo D.M. 28 marzo 2002 - Ministero della Salute (PDF), su antidroga.interno.gov.it.
- ^ J. Vose, T. Tighe, M. Schwartz e E. Buel, Detection of gamma-butyrolactone (GBL) as a natural component in wine, in Journal of Forensic Sciences, vol. 46, n. 5, 2001, pp. 1164–1167, DOI:10.1520/JFS15116J, PMID 11569560.
- ^ S. Elliott e V. Burgess, The presence of gamma-hydroxybutyric acid (GHB) and gamma-butyrolactone (GBL) in alcoholic and non-alcoholic beverages, in Forensic Science International, vol. 151, 2–3, 2005, pp. 289–292, DOI:10.1016/j.forsciint.2005.02.014, PMID 15939164.
- ^ a b (EN) Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, DOI:10.1002/14356007.a04_495.pub2.
- ^ Leonid Metsger e Shmuel Bittner, Autocatalytic Oxidation of Ethers with Sodium Bromate, in Tetrahedron, vol. 56, n. 13, marzo 2000, pp. 1905–1910, DOI:10.1016/S0040-4020(00)00098-3.
- ^ Sandmeyer Reaction of GABA to GBL/GHB, su erowid.org. URL consultato il 14 giugno 2018.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Gamma-butirrolattone
Wikimedia Commons contiene immagini o altri file su Gamma-butirrolattone
Collegamenti esterni
[modifica | modifica wikitesto]- Gamma-butirrolattone, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
- https://www.erowid.org/chemicals/ghb/gbl_info1.shtml
- https://web.archive.org/web/20080516215807/http://www.nida.nih.gov/whatsnew/meetings/GHB/default.html
- http://news.bbc.co.uk/2/hi/uk_news/magazine/4261788.stm
- The paint stripper drug that kills, BBC News, 7 ottobre 2005.