Reazioni di aldeidi e chetoni

Le aldeidi e i chetoni sono due classi di composti caratterizzate dal gruppo funzionale carbonile, che è molto polarizzato. Le principali reazioni di aldeidi e chetoni coinvolgono dunque l'attacco di un sostituente al carbonio carbonilico e spesso si risolvono in una semplice addizione.
Addizione nucleofila
[modifica | modifica wikitesto]La classe di reazioni di addizione nucleofila costituiscono probabilmente le reazioni più importanti delle aldeidi e i chetoni. Nel primo stadio l'agente nucleofilo attacca il carbonio carbonilico e il doppio legame carbonio-ossigeno si rompe, trasferendo il doppietto elettronico sull'ossigeno. Nel secondo stadio, per aggiunta di acidi, uno ione idrogenione (H+) si lega all'ossigeno. Due fattori sono importanti da considerare mentre ha luogo un'addizione nucleofila ad un'aldeide (o un chetone):
- Effetti sterici: maggiormente è complesso il substrato, meno va a completamento la reazione. L'ingombro sterico infatti impedisce l'inserimento del nucleofilo e pertanto la resa finale è molto bassa;
- Effetti elettronici: per aldeidi e chetoni mono o polisostituiti, è necessario considerare che i gruppi elettronattratori (come NO2 o gli alogeni) polarizzano ulteriormente il gruppo carbonilico, facilitando l'addizione nucleofila. Viceversa gruppi elettrondonatori (come alchili o il gruppo amminico, NH2) la sfavoriscono, andando a colmare la parziale carica positiva del carbonio carbonilico.
Spesso l'addizione nucleofila richiede catalisi acida: una coppia di elettroni non condivisa dell'ossigeno infatti attaccando l'H+ in soluzione porta alla formazione di un catione particolarmente stabile per risonanza.
Formazione di cianidrine
[modifica | modifica wikitesto]La formazione di cianidrine si ottiene per reazione di un'aldeide o chetone con l'acido cianidrico, HCN. Dal momento che l'acido cianidrico è debole, si suole trattarlo precedentemente in ambiente basico in modo da massimizzare la concentrazione del nucleofilo (che, ovviamente, è il gruppo cianuro, CN-). Il meccanismo di reazione segue quello dell'addizione nucleofila, per quanto nel secondo stadio lo ione idrogenione è dato dall'acqua (in modo da ripristinare la base che ha favorito la dissociazione dell'acido cianidrico). Le cianidrine sono interessanti intermedi nella sintesi organica.
Formazione di emiacetali e acetali (emichetali e chetali)
[modifica | modifica wikitesto]Per addizione di una o due molecole di alcol, aldeidi e chetoni danno rispettivamente dapprima emiacetali e emichetali e poi acetali e chetali. In un prestadio l'alcol viene indifferentemente trattato o con acidi o con basi in modo da ottenere il nucleofilo (RO-). Per il resto il meccanismo dell'addizione nucleofila viene rispettato: tuttavia, per quanto gli emichetali siano stabili, gli emiacetali tendono a degradare facilmente in acetali. Questo stadio viene catalizzato esclusivamente dagli acidi: esso infatti prevede un passaggio di disidratazione in cui il gruppo ossidrile (formatosi durante l'ottenimento dell'emiacetale/emichetale) attacca l'idrogenione ed esce dalla molecola come acqua. Il carbonio acquisisce dunque carica positiva e viene attaccato nuovamente dal nucleofilo, portando alla formazione del prodotto finale.
Formazione di immine
[modifica | modifica wikitesto]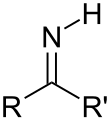
Le immine si ottengono per reazione di aldeidi e chetoni con ammoniaca o ammine. Dopo l'addizione nucleofila segue uno stadio di eliminazione (ricorda per certi versi quindi il meccanismo di addizione nucleofila acilica degli acidi carbossilici e derivati), in cui viene eliminata una molecola d'acqua (per condensazione tra il gruppo ossidrile e un idrogeno del nucleofilo): si forma quindi un doppio legame C=N.
Formazione di alcoli
[modifica | modifica wikitesto]
Si possono ottenere alcoli a partire da aldeidi e chetoni per trattamento degli stessi con reattivi di Grignard: in questo caso il nucleofilo è un gruppo alchilico che, in accordo al meccanismo dell'addizione nucleofila, attacca il carbonio carbonilico formando alcoli primari se il substrato di partenza era la formaldeide, alcoli secondari se era un'aldeide più complessa e alcoli terziari se era un chetone. Questo metodo costituisce una delle vie più versatili e diffuse per la preparazione di alcoli.
Riduzione
[modifica | modifica wikitesto]La riduzione di aldeidi e chetoni può portare selettivamente alla formazione di alcoli o di idrocarburi.
La riduzione ad alcoli avviene su scala industriale per idrogenazione catalica: in genere si usa come metallo elementare il nichel. Questo genere di riduzione avviene molto più lentamente dell'analoga utilizzata per gli alcheni: pertanto in presenza di composti con contemporaneamente un doppio legame C=C e il gruppo carbonilico, attraverso l'idrogenazione catalica si ottiene come prodotto esclusivo la molecola iniziale con il legame carbonio-carbonio ridotto. Per ovviare a ciò si può rimediare utilizzando catalizzatori più costosi, ma esclusivi nei confronti del carbonile, come il litio alluminio idruro (LiAlH4) e il sodio boroidruro (NaBH4).
La riduzione ad idrocarburi avviene alternativamente o in ambiente acido o in ambiente basico: nel primo caso si utilizza la riduzione di Clemmensen, che prevede il trattamento dell'aldeide o chetone con amalgama di zinco e acido cloridrico a ricadere; nel secondo caso interviene la riduzione di Wolff-Kishner che, mediante l'uso di idrazina e soda caustica, riduce l'aldeide o il chetone all'idrocarburo. In ambo i casi si ottiene lo stesso prodotto, un idrocarburo lineare.
Altre reazioni
[modifica | modifica wikitesto]Altre reazioni più complesse avvengono per la peculiare reattività dell'idrogeno in α, dovuta alla vicinanza con il carbonio carbonilico che porta una parziale carica positiva: l'acidità relativa dell'idrogeno consente l'attacco di basi all'aldeide (i chetoni in questo tipo di reazioni sono meno reattivi) e porta alla formazione di aldoli: la reazione, che comporta la perdita di una molecola d'acqua, viene detta condensazione aldolica.
Le aldeidi possono subire inoltre polimerizzazione a stadi in soluzione acquosa: ad esempio dall'aldeide formica si può ottenere paraformaldeide: questo polimero ad alte temperature libera a sua volta l'aldeide formica, rivelandosi un'ottima fonte solida di un prodotto gassoso. D'altro canto la sua eccessiva reattività alle altre temperature la rende poco utilizzabile: per questo si tende ad inattivare le sue estremità con formazione di acetali o esteri (il prodotto ottenuto è stato ribattezzato Delrin). Un'altra caratteristica delle aldeidi prive di idrogeni in α è la dismutazione subita in ambiente fortemente basico: questa reazione prende il nome di reazione di Cannizzaro. Le aldeidi aromatiche quali la benzaldeide sono possono dare la condensazione benzoinica.
Infine sia aldeidi che chetoni possono essere facilmente ossidati ad acidi carbossilici; le prime anche per azione di blandi ossidanti (come ad esempio lo ione Ag+ nella reazione di Tollens), i secondi tramite reagenti più energici come il permanganato di potassio.
Bibliografia
[modifica | modifica wikitesto]- Principi di chimica organica, Di Bello, Zanichelli, 2001, ISBN 8808248801
Voci correlate
[modifica | modifica wikitesto]- Aldeidi e chetoni
- Condensazione aldolica
- Condensazione benzoinica
- Reazione di Cannizzaro
- Riduzione di Wolff-Kishner
- Riduzione di Clemmensen
Collegamenti esterni
[modifica | modifica wikitesto]- Reazioni e saggi di riconoscimento di aldeidi e chetoni [collegamento interrotto], su itiskennedy.it.