Trimetilalluminio
| Trimetilalluminio | |
|---|---|
 | |
| Nome IUPAC | |
| Trimetilallumano | |
| Nomi alternativi | |
| Trimetilalluminio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H18Al2 (dimero) |
| Massa molecolare (u) | 144,18 (dimero) |
| Aspetto | liquido incolore |
| Numero CAS | Dimero 3D |
| Numero EINECS | 200-853-0 |
| PubChem | 16682925 |
| SMILES | C[Al](C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,752 |
| Temperatura di fusione | 15 °C (288 K) |
| Temperatura di ebollizione | 125 °C (398 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | 250-260-314 [1] |
| Consigli P | 222-223-231+232-280-370+378-422[1] |
Il trimetilalluminio, (TMA), è il composto organometallico di formula Al2(CH3)6, abbreviato come Al2Me6 o (AlMe3)2. In condizioni normali è un liquido incolore piroforico. Industrialmente è importante e viene utilizzato principalmente nei processi di polimerizzazione delle olefine e come agente metilante.
Struttura e proprietà
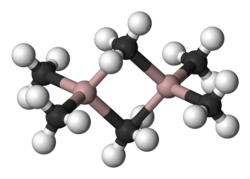
[modifica | modifica wikitesto]La molecola di Al2Me6 esiste come dimero, con struttura e legami simili a quelli del diborano. La coordinazione attorno all'alluminio è tetraedrica, e i due atomi di alluminio sono collegati tramite gruppi metilici a ponte usando legami a tre centri e due elettroni. Le distanze Al–Cterminale e Al–Ca ponte sono rispettivamente di 197 e 214 pm.[2] Gli atomi di carbonio dei metili a ponte sono pentacoordinati. I gruppi metilici terminali e a ponte si interscambiano rapidamente con meccanismi inter- e intramolecolari.
La specie monomerica AlMe3 è presente in quantità trascurabile in equilibrio con il dimero Al2Me6.[3]
Sintesi
[modifica | modifica wikitesto]Al2Me6 viene preparato industrialmente per reazione tra alluminio e clorometano; si forma un composto intermedio clorurato che viene poi ridotto con sodio:[3]
- 4Al + 6MeCl → 2Me3Al2Cl3
- 2Me3Al2Cl3 + 6Na → Al2Me6 + 2Al + 6NaCl
In passato piccole quantità di TMA erano preparate in laboratorio facendo reagire Al e dimetilmercurio:
- 2Al + 3HgMe2 → Al2Me6 + 3Hg
L'uso di questa reazione viene tuttavia evitato dato che il dimetilmercurio è estremamente tossico e pericoloso per l'ambiente.[3]
Reattività
[modifica | modifica wikitesto]Composti con legami a tre centri e due elettroni sono tipicamente elettron-deficienti e sono quindi acidi di Lewis. TMA è un acido di Lewis più forte dei composti organici del boro BR3. Per reazione con basi di Lewis si formano prodotti contenenti solo normali legami a due centri e due elettroni. Ad esempio la reazione con ammine fornisce addotti tipo R3N–AlMe3. TMA è inoltre un forte agente metilante.
La reazione con reagenti protici libera metano:
- Al2(CH3)6 + 6HX → 6CH4 + 2AlX3
Lo stesso schema di reazione vale anche per la reazione con acqua e alcoli:
- Al2(CH3)6 + 6H2O → 6CH4 + 2Al(OH)3
Usi
[modifica | modifica wikitesto]Il TMA viene utilizzato principalmente per produrre metilalluminossano, usato come co-catalizzatore del catalizzatore di Ziegler-Natta nei processi di polimerizzazione delle olefine. Il TMA è usato inoltre come metilante. Il reattivo di Tebbe, preparato usando TMA, è impiegato per metilare esteri e chetoni.
Trova applicazioni anche nella fabbricazione di semiconduttori per ottenere film sottili ad alta costante dielettrica, come Al2O3, tramite Chemical Vapor Deposition o Atomic Layer Deposition.
Il TMA è spesso rilasciato da razzi-sonda per evidenziare e studiare i venti nell'alta atmosfera.
Indicazioni di sicurezza
[modifica | modifica wikitesto]Il TMA è disponibile in commercio; è un composto pericoloso, da trattare con molta attenzione. Deve essere conservato e utilizzato in atmosfera inerte, dato che si infiamma spontaneamente all'aria. Reagisce violentemente con l'acqua, liberando metano (infiammabile). In caso di contatto provoca gravi ustioni a pelle e mucose e gravi lesioni oculari. Non ci sono dati che indichino proprietà cancerogene. [1] Viene venduto anche come soluzione in idrocarburi inerti come toluene, esano o eptano; in questa forma i rischi di accensione sono minori.
Note
[modifica | modifica wikitesto]- ^ a b c Trimethylaluminum Sigma-Aldrich. Url consultato 05-05-2014
- ^ Holleman e Wiberg 2001
- ^ a b c Mason 2006
Bibliografia
[modifica | modifica wikitesto]- (EN) A. F. Holleman e E. Wiberg, Inorganic chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
- (EN) M. R. Mason, Aluminum: Organometallic Chemistry, in Encyclopedia of Inorganic Chemistry, Wiley, 2006, DOI:10.1002/0470862106.ia008.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Trimetilalluminio
Wikimedia Commons contiene immagini o altri file su Trimetilalluminio
| Controllo di autorità | GND (DE) 4186149-8 |
|---|