転写因子
この記事は英語版の対応するページを翻訳することにより充実させることができます。(2023年10月) 翻訳前に重要な指示を読むには右にある[表示]をクリックしてください。
|
| 転写因子関連用語集 |
|---|
転写因子(てんしゃいんし、英語: Transcription Factor、TF)はDNAに特異的に結合するタンパク質の一群である。DNA上のプロモーター領域に、基本転写因子と呼ばれるものと、RNAポリメラーゼ(RNA合成酵素)が結合し、転写が開始する。DNAの遺伝情報をRNAに転写する過程を促進、あるいは逆に抑制する。転写因子はこの機能を単独で、または他のタンパク質と複合体を形成することによって実行する。ヒトのゲノム上には、転写因子をコードする遺伝子がおよそ1,800前後存在するとの推定がなされている[1]。
生物学的役割
[編集]転写因子はDNAの配列を認識・結合し、遺伝子の発現を制御するという基本的機能を持つ。遺伝子の転写を活性化あるいは逆に不活性化することで、細胞内の多くの反応で重要な役割を果たしている。とりわけ重要な機能のいくつかを以下に示す。
基本的転写調節
[編集]真核生物では、転写の開始には基本転写因子(GTF)の存在が必要である。基本転写因子の多くは実際にはDNAに結合せず、大型の転写開始前複合体(preinitial complex)の一部として存在し、RNAポリメラーゼと直接的に相互作用する。最も一般的な基本転写因子としてTFIIA、TFIIB、TFIID、TFIIE、TFIIF、TFIIHなどがある。
発生
[編集]多数の転写因子が多細胞生物の発生に関与している。これらの転写因子は刺激に応じて、対象とする遺伝子の転写を開始あるいは停止させる。これにより、細胞形態や活動を適宜変化させ、細胞の運命決定や分化を進めるために必要な状態を作り出すことができる。例えば、Hoxファミリーに属する転写因子は、ショウジョウバエからヒトに至る多様な生物において、適切な身体構造を作るために重要な働きをする。他の例として、Y染色体上にあるSex-determining Region Y(SRY)にコードされる転写因子があり、哺乳類の性決定で主要な役割を果たす。
細胞間シグナル伝達への応答
[編集]細胞間の情報伝達は、ある細胞が放出した分子が、別の細胞内にシグナル伝達の連鎖反応(カスケード)を引き起こすことによって行われる。遺伝子の活性化/不活性化を必要とするシグナル経路では、しばしばカスケードの下流に転写因子の存在がある。エストロゲンシグナルはかなり短いカスケードを持つ例で、エストロゲン受容体転写因子が関与する。エストロゲンは卵巣や胎盤から分泌され、細胞膜を通過し細胞質内に存在するエストロゲン受容体に結合する。エストロゲン受容体は核内に移動し、特定のDNA配列に結合、関連する遺伝子の転写を調節する。
環境への応答
[編集]転写因子の活動の場は生物学的刺激に対するシグナル伝達だけではなく、環境刺激に対しても転写因子の作用が関わっている。高温条件下で生存するために必須の遺伝子を活性化する熱ショック因子(en)(HSF)、低酸素環境に対応する低酸素誘導因子(HIF)、あるいは細胞内の適切な脂質レベルを維持するステロール調節配列結合タンパク質(Sterol Regulatory Element Binding Protein; SREBP)などがその例である。
細胞周期調節
[編集]多くの転写因子が細胞周期の調節に関与する。細胞がどこまで大きくなり、どのタイミングで分裂を行うかの決定を補助する。細胞周期調節は特にがん遺伝子やがん抑制遺伝子に誘導される転写因子の働きとして重要である。著明な例として細胞の成長とアポトーシスに作用するMyc蛋白がある。
転写因子の活性制御機構
[編集]重要な生物学的反応には多段階の調節・制御機構が設けられているが、転写もその例外ではない。転写レートの制御は遺伝子産物(RNAやタンパク質)の量を調節するだけでなく、転写の過程それ自身をも調節している。以下に、転写因子の活動を制御するシステムの簡潔な一覧を示す。
転写因子合成
[編集]他のタンパク質と同様に、転写因子は染色体上の遺伝子からRNAに転写され、タンパク質へと翻訳される。これらのどのステップも、転写因子の産生と活性に影響し得る。ある転写因子は、自分自身の産生を抑制する働きを示すこともある(ネガティブフィードバック)。転写因子が自分自身をコードする遺伝子に結合する場合、通常は抑制する方向に働く。これは細胞内での転写因子レベルを低く維持するメカニズムの一つである。
核への局在
[編集]真核生物においては、転写因子の転写は核内で、翻訳は細胞質内で行われる。核内で活動するタンパク質の多くは、自身を核内へ導くための核局在化シグナルを持っている。しかし、多くの転写因子にとって、核移行のプロセスは制御のキーポイントである。ある種の転写因子(核内受容体など)は、核移行するためには細胞質内でリガンドと結合する必要がある。
リガンド結合/化学的修飾による活性化
[編集]リガンドとの結合は転写因子の局在だけでなく、転写因子の活性状態(DNAや共役因子と結合し得るか否か)にも影響を与える。また、リン酸化を受けることでDNAに結合できるようになるSTAT蛋白のように、化学的修飾によって活性化を受ける転写因子も多く存在する。
DNA結合領域への接近性
[編集]真核生物の場合、転写活性の低い遺伝子領域は、ヒストンやクロマチン線維が凝縮されたヘテロクロマチンの状態にある。ヘテロクロマチンの内部にあるDNAには、多くの転写因子は接触することはできない。この状態からDNAに結合するためには、ヒストンの構造を変化させるなどして、まずユークロマチンの状態に変化させる必要がある。
あるDNA領域に既に結合している転写因子も、同じ部位を結合対象とする他の転写因子にとっては、結合を妨げる要因と見なせる。このように、同じ遺伝子を対象とする複数の転写因子が、1つは転写を促進、別のものは抑制というように、互いに拮抗的な役割を演じることもある。
共役因子の利用/複合体形成
[編集]ほとんどの転写因子は単独では機能せず、遺伝子の転写には多数の転写因子の結合が必要となる。この転写因子の集合体は、前開始複合体やRNAポリメラーゼの効果的な補填を行うための共役因子を次々に補充する。このように、1つの転写因子が転写を開始するためには、他に必要なタンパク質が全て存在し、結合可能な状態でなければならない。
構造
[編集]転写因子は高度にモジュール化された構造を持つ[2]。すなわち、転写制御に関与する様々な機能を持った領域(ドメインとも呼ばれる)が、1つの転写因子の中に組み込まれている。各機能領域の配列や数は転写因子によって異なり、シグナル検知とトランス活性化機能は同じ領域に含まれることが多い。
- DNA結合領域(DNA binding domain; DBD)
- DNAの特定の配列(遺伝子の近傍にあるプロモーターやエンハンサー配列など)に結合する領域。転写調節に直接関わる、最も重要な領域である(下記に詳述)。転写因子が結合するDNA配列は、しばしばホルモン応答配列とみなされる。
- トランス活性化領域(transactivation domain; TAD)
- 他のタンパク質(共役転写調節因子など)と結合するための領域。この部分は「活性化機能(activation functions)」と呼ばれることが多い[3]。
- シグナル検知領域(signal sensing domain; SSD)またはリガンド結合領域
- 外部からのシグナルを検出し、複合体を形成する残りの部分に伝達することで、遺伝子の発現を制御する。SSDとDBDが別々の転写因子上に存在し、複合体を形成して初めて互いに機能するといった場合もある。
DNA結合領域
[編集]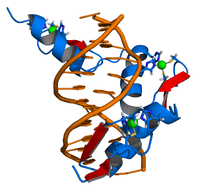

転写因子は複数の機能領域から構成されるため、その構造解析は簡単ではない。しかし、実際にDNAに結合する部分であるDNA結合領域に基づく解析・分類は比較的進んでいる。以下に、代表的なDNA結合領域の分類を示す。
- ホメオドメイン(homeodomain)
- ショウジョウバエの身体構造決定に関与する転写因子から見出されたモチーフで、ヒトを含む高等動物でもよく保存されている。ヘリックスターンヘリックス(HTH)構造を持ち、2番目のヘリックスがDNAを認識する。
- ジンクフィンガー(zinc finger)
- ステロイドホルモン受容体などの核内受容体、GATAファミリー因子などに見られる構造で、亜鉛を配位することで特定の立体構造をとり、DNAに結合する。共通するアミノ酸配列に基づいて、C2H2タイプ、C4タイプなどに分類されている。
- 塩基性ヘリックスループヘリックス(basic-helix-loop-helix; bHLH)
- HLHはダイオキシン受容体や筋細胞分化に関わる転写因子に見られ、転写因子同士の結合に重要な構造である。二量体を形成した転写因子の、2つの塩基性領域がDNAを認識する。
- 塩基性ロイシンジッパー(basic region –leucine zipper; bZip)
- アミノ酸7つごとにロイシンあるいはイソロイシンが配置された特徴的なαヘリックス構造を持ち、転写因子の二量体形成に関わる。形成された二量体の塩基性領域がDNAを認識する。
他にWinged helix(WH)、ETSなどいくつかのモチーフが知られている。また、DNA結合領域を持たないために転写因子とは分類されないものの、転写調節に決定的な役割を持つタンパク質が存在する[4]。補助活性化因子、クロマチン再構成複合体(Chromatin Structure Remodeling; RSC)、ヒストンアセチル基転移酵素、リン酸化酵素、メチル化酵素などが当てはまる。
転写因子結合領域
[編集]転写因子が結合するDNA配列のことを、転写因子結合領域と呼ぶ。転写因子は水素結合とファンデルワールス力の組み合わせにより、これらの領域と化学的に結合する。これらの化学的相互作用の特性から、ほとんどの転写因子は個々のDNA配列に特異的に結合する。しかし、転写因子結合領域の全ての塩基が実際に転写因子と接触するわけではなく、また結合力の程度も部位によってまちまちである。このため、転写因子はたった1つのDNA配列にしか結合しないということはなく、似通った配列を持つ複数の領域を結合対象とすることができる。
例として、TATA結合タンパク質(en)(TBP)と呼ばれる転写因子群の共通の結合領域は「TATAAAA」であるが、TBPはこれに類似した配列である「TATATAT」あるいは「TATATAA」にも結合することができる。
転写因子はこのように似通った配列に結合可能で、しかも比較的短い配列を対象とする傾向がある。このため、DNAが充分に長ければ、結合可能な領域が偶然現れても不思議ではない。ところが実際には、転写因子が互換性のある全ての配列に結合するということはない。DNAへの接近性や共役因子の利用可能性など、他の制約が転写因子の実際の結合範囲を狭めている。したがって、あるDNA配列が判明したとしても、そこに実際に転写因子が結合するかどうかの予測は簡単にはできない。
転写因子が関与する疾患
[編集]転写因子は生物の発生、細胞間シグナル伝達、細胞周期などで重要な役割を果たすため、その変異がヒトの疾患の原因となることがある。比較的よく研究されている例を以下に挙げる。
- レット症候群(Rett syndrome)-MECP2(en)転写因子の変異による、神経発達疾患。
- 糖尿病-MODY(Maturity onset diabetes of the young)と呼ばれる糖尿病の稀なタイプが、肝細胞核因子(HNF)やインスリンプロモーター因子1(IPF1)の変異によって起こることがある。
- 発達性言語協調障害(developmental verbal dyspraxia)-FOXP2の変異によって起こる。正しく発声するための協調運動が困難になる疾患。
- IPEX(immunodysregulation polyendocrinopathy enteropathy X-linked syndrome)-FOXP3(en)の変異によって起こる、稀な自己免疫疾患。
- その他-がん遺伝子/がん抑制遺伝子として働く転写因子は多く、これらの変異や調節異常が発がんの原因となることがある。リー・フラウメニ癌症候群(Li-Fraumeni syndrome)はがん抑制因子であるp53の変異を原因とする。
分類
[編集]機構的分類
[編集]転写因子はその機構に基づき、3種類に分類されている。
- 基本転写因子
- 転写開始開始前複合体の形成に関与する。あらゆる細胞に存在し、クラスII遺伝子(en)周囲のコアプロモーター領域と相互作用する[5]。
- 上流転写因子
- 転写開始点の上流(プロモーター)に結合し、転写促進/抑制を行う転写因子。転写調節因子ともいう。
- 誘導型転写因子
- 上流転写因子に似るが、機能発現のために活性化/抑制を必要とする。
機能的分類
[編集]機構的分類とは別に、制御機能に基づく分類もある[4]。
- 1. 構成的活性化型-全ての細胞に、常時存在するタイプ。基本転写因子、Sp1、NF1、CCAATエンハンサー結合蛋白(en)など。
- 2. 条件付活性化型-活性化を必要とするタイプ。
- 2.A 発生型 (細胞特異的) -発現が厳密に制御されるが、いったん発現するとさらなる活性化は不要。GATA転写因子、肝細胞核因子(HNF)、PIT-1、MyoD、Myf5、Hox、Winged Helixなど。
- 2.B シグナル依存型-活性化には外部からのシグナルが必要。
DNA結合領域による分類
[編集]最も細分化された転写因子の分類として、DNA結合領域をメインとしたものがある[6][7]。ここではSuperclass・Class・Familyの3段階までを記すが、Subfamilyなどさらに下位分類を設ける場合もある。
- 1 基本ドメイン
- 1.1 塩基性ロイシンジッパー
- 1.2 塩基性ヘリックスループヘリックス
- 1.2.1 ユビキタス因子(class A)
- 1.2.2 筋原性転写因子(MyoD)
- 1.2.3 Achaete-Scute
- 1.2.4 Tal/Twist/Atonal/Hen
- 1.3 ヘリックスループヘリックス/ロイシンジッパー(bHLH-ZIP)
- 1.3.1 ユビキタスbHLH-ZIP因子(USF、SREBPなど)
- 1.3.2 細胞周期調節因子(c-Mycなど)
- 1.4 NF-1
- 1.4.1 NF-1(NFIC)
- 1.5 RF-X
- 1.5.1 RF-X(NFX)
- 1.6 bHSH
- 2 亜鉛配位DNA結合ドメイン
- 3 ヘリックスターンヘリックス
- 3.1 ホメオボックス
- 3.1.1 ホメオドメインのみ(Ubx)
- 3.1.2 POU因子(Octなど)
- 3.1.3 LIM領域を持つホメオドメイン
- 3.1.4 ジンクフィンガーを持つホメオドメイン
- 3.2 Paired box
- 3.2.1 ホメオドメインを持つPaired box
- 3.2.2 Paired boxのみ
- 3.3 Fork head/Winged helix
- 3.3.1 発生調節因子(forkheadなど)
- 3.3.2 組織特異的調節因子
- 3.3.3 細胞周期調節因子
- 3.3.0 他の調節因子
- 3.4 熱ショック因子(HSF)
- 3.4.1 HSF
- 3.5 トリプトファンクラスター
- 3.5.1 Myb
- 3.5.2 Etsタイプ
- 3.5.3 インターフェロン調節因子
- 3.6 TEAドメイン
- 3.6.1 TEA
- 3.1 ホメオボックス
- 4 β-Scaffold因子(Minor Groove Contactを伴う)
- 4.1 RHR(Rel homology region)
- 4.1.1 Rel/ankyrin、NF-kB
- 4.1.2 ankyrinのみ
- 4.1.3 NF-AT
- 4.2 STAT
- 4.2.1 STAT
- 4.3 p53
- 4.3.1 p53
- 4.4 MADSボックス
- 4.4.1 分化調節因子(Mef2など)
- 4.4.2 細胞外シグナル応答因子(SRF)
- 4.4.1 分化調節因子(Mef2など)
- 4.5 β-Barrel α-helix
- 4.6 TATA結合蛋白(TBP)
- 4.6.1 TBP
- 4.7.1 SOX、SRY
- 4.7.2 TCF-1
- 4.7.3 HMG2関連因子、SSRP1
- 4.7.5 MATA
- 4.8 Heteromeric CCAAT factor
- 4.8.1 Heteromeric CCAAT factors
- 4.9 Grainyhead
- 4.9.1 Grainyhead
- 4.10 寒冷ショックドメイン
- 4.10.1 csd
- 4.11 Runt
- 4.11.1 Runt
- 4.1 RHR(Rel homology region)
- 0 他の転写因子
- 0.1 銅フィストタンパク質
- 0.2 HMGI(Y)
- 0.2.1 HMGI(Y)
- 0.3 ポケットドメイン
- 0.4 E1A類似因子
- 0.5 AP-2/EREBP関連因子
脚注
[編集]出典
[編集]- ^ 『転写因子による生命現象解明の最前線』 p.25
- ^ Latchman DS (1997). “Transcription factors: an overview”. Int. J. Biochem. Cell Biol. 29 (12): 1305-12. PMID 9570129.
- ^ Wärnmark A, Treuter E, Wright AP, Gustafsson J-Å (2003). “Activation functions 1 and 2 of nuclear receptors: molecular strategies for transcriptional activation”. Mol. Endocrinol. 17 (10): 1901-9. PMID 12893880.
- ^ a b Brivanlou AH, Darnell JE (2002). “Signal transduction and the control of gene expression”. Science 295 (5556): 813-8. PMID 11823631.
- ^ Orphanides G, Lagrange T, Reinberg D (1996). “The general transcription factors of RNA polymerase II”. Genes Dev. 10 (21): 2657-83. PMID 8946909.
- ^ Stegmaier P, Kel AE, Wingender E (2004). “Systematic DNA-binding domain classification of transcription factors”. Genome informatics. International Conference on Genome Informatics 15 (2): 276-86. PMID 15706513.
- ^ “TRANSFACR database”. 2007年8月5日閲覧。
参考文献
[編集]- 五十嵐和彦ほか編 『転写因子による生命現象解明の最前線』 羊土社 2007年 ISBN 978-4-7581-0283-4
- 半田宏編 『転写がわかる-基本転写から発生、再生、先端医療まで』 羊土社 2002年 ISBN 4-89706-994-7