ロレンチーニ器官

ロレンチーニ器官(ロレンチーニきかん、英:Ampullae of Lorenzini)とは、微弱な電流を感知する電気受容感覚の1種である。ロレンチーニ瓶(ロレンチーニびん)とも称される[1]。軟骨魚類、アミメウナギ[2]、チョウザメ目[3]、ハイギョが持っており、皮膚にある粘液で満たされた孔が神経でつながっている[2]。初期の脊椎動物が持っていた側線のような感覚器官と関連しており、ほとんどの硬骨魚類と陸上生物はロレンチーニ器官を失っている。
歴史
[編集]マルチェロ・マルピーギは最初にロレンチーニ器官について記述し、1700年代後期にイタリアのステファノ・ロレンチーニによって正確に記述され、彼の名前にちなんで命名された。当時から何らかの感覚器官であろうと言われていたが、その具体的な機能は不明であった[4]。20世紀に行われた電気生理学的実験により、温度、圧力、おそらく塩分に対する感受性が示唆された。1960年に、ロレンチーニ器官は電場を感知するための特殊な受容器官であることが明らかになった[5][6]。カルシウム活性化カリウムチャネルに関する最初の記述の1つは、ガンギエイ目魚類のロレンチーニ器官の研究に基づいたものであった[7]。
進化
[編集]ロレンチーニ器官は、初期の脊椎動物の側線のような器官と関連しており、そこから進化したと考えられている。膨大部を使用した電気受容は脊椎動物の祖先の形質であり、これは脊椎動物の最後の共通祖先にロレンチーニ器官が存在していたことを意味する[8]。ロレンチーニ器官は、軟骨魚類、ハイギョ、ポリプテルス、シーラカンス、チョウザメ、ヘラチョウザメ、水生サンショウウオ、アシナシイモリなどに存在する。ロレンチーニ器官は硬骨魚類や四肢動物の進化の初期に失われたようだが、その証拠は不十分である[8]。
| 脊椎動物 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
解剖学
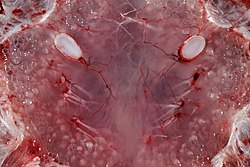
[編集]コラーゲンの鞘内では複数の神経繊維を含む感覚細胞の束が形成されており、これを膨大部という。膨大部はゲルで満たされた管と皮膚の細孔を含む。ゲルは、海水と同じ抵抗率と半導体に似た電気特性を持つ糖タンパク質ベースの物質である[4][9][10]。
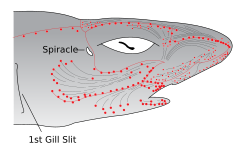
孔は、サメやエイの鼻孔と口の周囲の皮膚、ならびに前鼻弁、ひげ、ひだ、および下唇の溝に集中している。管のサイズは通常、動物の体の大きさに対応するが、膨大部の数は同じである。ロレンチーニ器官の管には、孔が開いている場合とそうでない場合がある。孔のない管は、外部の流体の動きとは相互作用せず、異物の干渉を防ぐ触覚受容体としての機能を果たす[11]。
-
イタチザメの頭部。細孔がはっきりと見える
-
ロレンチーニ器官における電気受容器(赤点)は、初期の脊椎動物の側線器官(灰色線)から進化した。
-
ロレンチーニ器官内部。白い丸型の構造は膨大部である。
電気受信
[編集]ロレンチーニ器官は、水中の電場を検知することができる。より正確には、皮膚の細孔にある電気受容体細胞基部の電圧との電位差を検出する[7][12][13]。100万分の1ボルトという極小の電位差を感知できる。
正の細孔刺激は電気受容細胞からの神経伝達の速度を低下させ、負の細孔刺激は速度を増加させる。各膨大部には、支持細胞によって分離された単一層の受容体細胞が含まれる。細胞は頂端の密着結合によって接続されており、細胞間で電流が漏れることは無い。受容細胞の頂端面は表面積が小さく、電位依存性カルシウムチャネル(脱分極を引き起こす)とカルシウム活性化カリウムチャネル(その後の再分極を行う)が高濃度で存在する[14]。
管壁の抵抗は非常に高いため、管の孔と膨大部の間の電位差はすべて、厚さ50ミクロンの受容体上皮を介する。受容体細胞の基底膜は抵抗が低いため、電圧の大部分は閾値にある興奮可能な頂端面全体で降下する。受容体細胞を横切る内向きのカルシウム電流は基底面を脱分極させ、大きな活動電位、つまり脱分極の後に再分極が起こる波を引き起こす。これにより、シナプス前でのカルシウムの放出と求心性神経繊維への興奮性伝達物質の放出が引き起こされる。これらの繊維は、検出された電場の大きさを脳に伝える[15]。
膨大部には伝導度の大きいカルシウム活性化カリウムチャネルがある。サメは他のどの動物よりも電界に対して敏感で、感受性閾値は5 nV/cmと低い。膨大部の管を満たすゲルであるコラーゲンゼリーは、あらゆる生物材料の中で最も高いプロトン伝導性を持つものの1つである。これは97%の水にケラタン硫酸を含み、伝導率は約1.8 mS/cmである[12][15][16]。すべての動物は筋肉の収縮によって電場を発生させる。電気受容性の魚は獲物の筋肉の収縮から弱い電気刺激を感知する可能性がある[7]。
ノコギリエイは他の軟骨魚類よりも多くの孔を持ち、電気受信能力が高い。頭部、吻側の腹側と背側、体の背側にロレンチーニ器官を持つ[17]。
磁器受信
[編集]ロレンチーニ器官は、地磁気情報を受け取る能力もある。磁場と電場は関連しているため、電磁誘導による磁気受信が可能である。多くの軟骨魚類は、人工的に生成された磁場に反応し、その能力を示す。磁気受信は、サメやエイが厳密な移動パターンを形成し、地理的位置を特定する能力を説明できる可能性がある[18]。
温度感覚
[編集]チューブ内の粘液状の物質は、おそらく熱電半導体として機能し、温度変化を電気信号に変換し、温度勾配を検出するために使用できると2003年に考えられていた[19]。2007年の研究はこれを反証した[20]。疑問は未解決のままで[21]、2023年にはサメのロレンチーニ器官が0.001ケルビンの温度差を検出できるようになると予測された。同じ原理を使用した人工センサーは、0.01ケルビンの違いを検出できる[22]。
POD
[編集]グレーム・チャーター博士 (Dr. Graeme Charter) とノーマン・スターキー (Norman Starkey) はロレンチーニ器官の機能に着目し、潜水士用にPOD(Protective Oceanic Deviceの略。一般には、シャークシールドと呼ばれる。)を開発した。PODは電磁波を発生させた空間を形成することにより、ホホジロザメを近寄らせないようにできる。これまで使われてきたサメ避け網(一般には、シャークネットと呼ばれる)は、サメを傷つけたり殺したりしてしまう可能性があった。
出典
[編集]- ^ 「ロレンチーニ器官」『日本大百科全書、デジタル大辞泉』。コトバンクより2022年6月25日閲覧。
- ^ a b “Ultrastructure of the ampullary electroreceptors in lungfish and Brachiopterygii”. Cell and Tissue Research 173 (1): 95–108. (October 1976). doi:10.1007/BF00219268. PMID 991235.
- ^ “Development of the lateral line system in the shovelnose sturgeon”. Brain, Behavior and Evolution 64 (2): 70–84. (2004). doi:10.1159/000079117. PMID 15205543.
- ^ a b Baranes, Avi; Fishelson, Lev (6 January 1999). “Distribution, morphology, and cytology of ampullae of Lorenzini in the Oman shark, Iago omanensis (Triakidae), from the Gulf of Aqaba, Red Sea”. The Anatomical Record 251 (251: 417–430): 417–430. doi:10.1002/(SICI)1097-0185(199808)251:4<417::AID-AR1>3.0.CO;2-P. PMID 9713980 21 March 2022閲覧。.
- ^ “Electrical sensitivity of the ampullae of Lorenzini”. Nature 187 (4741): 957. (September 1960). Bibcode: 1960Natur.187..957M. doi:10.1038/187957a0. PMID 13727039.
- ^ “The response of the ampullae of Lorenzini of elasmobranchs to electrical stimulation”. The Journal of Experimental Biology 39: 119–28. (March 1962). doi:10.1242/jeb.39.1.119. PMID 14477490.
- ^ a b c “The shark's electric sense.”. Scientific American 297 (2): 74–81. (August 2007). Bibcode: 2007SciAm.297b..74F. doi:10.1038/scientificamerican0807-74. JSTOR 26069417. PMID 17894175.
- ^ a b “The phylogenetic distribution of electroreception: Evidence for convergent evolution of a primitive vertebrate sense modality”. Brain Research Reviews 6 (1): 25–46. (1983). doi:10.1016/0165-0173(83)90003-6. hdl:2027.42/25137. PMID 6616267.
- ^ “Semiconductor gel in shark sense organs?”. Neuroscience Letters 426 (3): 166–70. (October 2007). doi:10.1016/j.neulet.2007.08.064. PMC 2211453. PMID 17904741.
- ^ “Ultrastructure of the ampullae of Lorenzini of Aptychotrema rostrata (Rhinobatidae)”. Zoomorphology 128 (1): 45–52. (2009-02-01). doi:10.1007/s00435-008-0073-5. ISSN 1432-234X.
- ^ “Electroreceptive and mechanoreceptive anatomical specialisations in the epaulette shark (Hemiscyllium ocellatum)”. PLOS One 7 (11): e49857. (2012). Bibcode: 2012PLoSO...749857W. doi:10.1371/journal.pone.0049857. PMC 3511481. PMID 23226226.
- ^ a b “Electroreception in early vertebrates: survey, evidence and new information.”. Palaeontology 61 (3): 325–58. (May 2018). doi:10.1111/pala.12346.
- ^ “Electroreception in marine fishes: chondrichthyans”. Journal of Fish Biology 95 (1): 135–154. (July 2019). doi:10.1111/jfb.14068. PMID 31169300.
- ^ “Calcium-activated conductance in skate electroreceptors: current clamp experiments”. The Journal of General Physiology 69 (2): 121–43. (February 1977). doi:10.1085/jgp.69.2.121. PMC 2215012. PMID 190338.
- ^ a b “Molecular tuning of electroreception in sharks and skates”. Nature 558 (7708): 122–126. (June 2018). Bibcode: 2018Natur.558..122B. doi:10.1038/s41586-018-0160-9. PMC 6101975. PMID 29849147.
- ^ “Proton conductivity in ampullae of Lorenzini jelly”. Science Advances (2016年5月13日). 2017年8月19日閲覧。
- ^ “Sensory systems in sawfishes. 1. The ampullae of Lorenzini”. Brain, Behavior and Evolution 78 (2): 139–49. (2011). doi:10.1159/000329515. PMID 21829004.
- ^ “The yellow stingray (Urobatis jamaicensis) can discriminate the geomagnetic cues necessary for a bicoordinate magnetic map”. Marine Biology 167 (10): 151. (2020-09-29). doi:10.1007/s00227-020-03763-1.
- ^ “Sensing temperature without ion channels”. Nature 421 (6922): 495–495. (30 January 2003). doi:10.1038/421495a. ISSN 0028-0836.
- ^ “Semiconductor gel in shark sense organs?”. Neuroscience Letters 426 (3): 166–170. (2007-10-22). doi:10.1016/j.neulet.2007.08.064. ISSN 0304-3940. PMC 2211453. PMID 17904741.
- ^ “Temperature response in electrosensors and thermal voltages in electrolytes”. Journal of Biological Physics 36 (2): 121–134. (March 2010). doi:10.1007/s10867-009-9174-8. PMC 2825305. PMID 19760113.
- ^ “Solid state ionics enabled ultra-sensitive detection of thermal trace with 0.001K resolution in deep sea”. Nature Communications 14 (1). (12 January 2023). doi:10.1038/s41467-022-35682-8. ISSN 2041-1723. PMC 9837202.