아세틸렌
| |

| |

| |
| 이름 | |
|---|---|
| 우선명 (PIN)
Acetylene[1] | |
| 체계명
Ethyne[2] | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| 906677 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.743 |
| EC 번호 |
|
| 210 | |
| KEGG | |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
| UN 번호 | 1001 (dissolved) 3138 (in mixture with ethylene and propylene) |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C2H2 | |
| 몰 질량 | 26.038 g·mol−1 |
| 겉보기 | Colorless gas |
| 냄새 | Odorless |
| 밀도 | 1.097 g/L = 1.097 kg/m3 |
| 녹는점 | −80.8 °C (−113.4 °F; 192.3 K) Triple point at 1.27 atm |
| −84 °C; −119 °F; 189 K (1 atm) | |
| slightly soluble | |
| 증기 압력 | 44.2 atm (20 °C)[3] |
| 산성도 (pKa) | 25[4] |
| 짝산 | Ethynium |
자화율 (χ)
|
−12.5×10−6 cm3/mol |
| 구조 | |
| Linear | |
| 열화학 | |
표준 몰 엔트로피 (S
|
201 J/(mol·K) |
표준 생성 엔탈피 (ΔfH⦵298)
|
+226.88 kJ/mol |
| 위험 | |
| GHS 그림문자 |  
|
| 신호어 | 위험 |
| H220, H336 | |
| P202, P210, P261, P271, P304, P340, P312, P377, P381, P403, P403, P233, P405, P501 | |
| NFPA 704 (파이어 다이아몬드) | |
| 300 °C (572 °F; 573 K) | |
| NIOSH (미국 건강 노출 한계): | |
PEL (허용)
|
none[3] |
REL (권장)
|
C 2500 ppm (2662 mg/m3)[3] |
IDLH (직접적 위험)
|
N.D.[3] |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
아세틸렌(Acetylene) 또는 에타인(Ethyne, 에틴)은 알카인 계의 탄화수소중 가장 간단한 형태의 화합물이다. 화학식은 C2H2이다.
고농도에서 흡입 시 마취 효과가 나타날 수 있다. 산소부족으로 인한 숨 가쁨, 정신적 경계심의 감소, 근육 조정의 손상, 판단력 상실, 감각의 무뎌짐, 정신적 불안정, 피로를 일으킬 수 있다. 질식의 과정으로 구역질, 구토, 피로, 의식 상실 등이 일어날 수 있으며 심할 경우 발작, 혼수상태, 사망에까지 이를 수 있다. 임산부에게서의 산소 부족은 태아 발육에 지장을 줄 수 있다.
성질
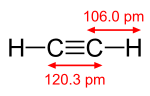
[편집]상온에서 무색 무취의 기체상태로 존재하며, 비중은 공기가 1일 때 0.9057이다. 녹는점은 -81.5°C, 끓는점은 -84°C이며 임계온도는 36.5°C, 입계압력은 61.6atm이다. C≡C 결합 길이는 1.20Å, C-H 결합 길이는 1.06Å이다. 생성열은 50kcal이며 연소열은 312.9kcal이다. 물과 알코올에는 보통정도로 녹으며, 아세톤에는 특별히 잘 녹는다. 공기 중에서 태울 경우 그을음을 내며 탄다. 연소 시에 매우 많은 열을 내놓기 때문에 용접 등 높은 온도가 필요한 작업에서 주로 사용된다.
화학적 성질
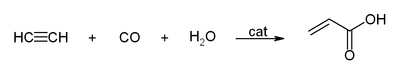
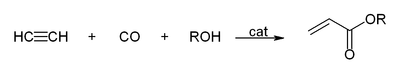
[편집]아세틸렌의 삼중 결합에는 다량의 에너지가 포함되어 있어, 반응성이 풍부하다. 아세틸렌과 관련된 반응으로는 다음과 같은 것이 있다.
- 염소와 반응하여 1,1,2,2-테트라클로로에테인, 1,2-다이클로로에테인 등과 같은 화합물을 생성한다.
- 브로민과 반응하여 1,1,2,2-테트라브로모에테인, 1,2-다이브로모에테인 등과 같은 화합물을 생성한다.
- 염화 수소, 브로민화 수소, 아이오딘화 수소와 반응하여 각각 1,1-다이클로로에테인, 1,1-다이브로모에테인, 1,1-다이아이오도에테인을 생성한다.
- 황산 수은 등의 촉매 존재 하에 물과 반응하여 아세트알데하이드를 생성한다.
- 촉매 존재 하에 수소와 반응하여 에틸렌이나 에테인을 생성한다.
- 나트륨과 반응하여 C2HNa, C2Na2 등의 화합물을 생성한다.
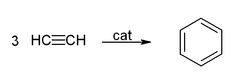
- 아세틸렌 3분자가 중합되면 벤젠이 만들어진다. 반응식은 다음과 같다.
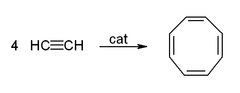
- 아세틸렌 4분자가 중합되면 사이클로옥타테트라엔이 만들어진다. 반응식은 다음과 같다.
제조법
[편집]아세틸렌을 만드는 방법은 크게 탄화 칼슘을 이용한 제조법과 탄화수소 분해를 이용한 제조법으로 나뉜다.
탄화 칼슘은 물과 반응하기 쉬우며, 반응 시 발열이 수반된다. 반응식은 다음과 같다.
탄화 칼슘 1kg은 약 230~290l의 아세틸렌을 발생하고, 이때의 발열량은 약 400kcal에 달한다. 탄화 칼슘을 이용한 아세틸렌 제조법은 건식과 습식의 두 가지 방법이 있다. 습식은 다량의 물에 탄화 칼슘을 투입하여 아세틸렌을 발생하는 방법이고, 건식은 탄화 칼슘 덩어리 또는 분말에 물을 분사시켜 아세틸렌을 얻는 방법이다. 습식의 경우 다량의 수산화 칼슘 찌꺼기를 남기기 때문에, 건식이 더 선호되는 추세이다.
메테인, 에테인, 프로페인 등의 탄화수소를 분해하여 아세틸렌을 얻는 방법이다. 메테인을 사용할 경우 반응식은 다음과 같다.
반응식을 보면 알 수 있듯이, 탄화수소분해 반응은 흡열 반응이다. 따라서 이 반응을 진행시키기 위해서는 많은 열이 필요하다.
위험성
[편집]아세틸렌은 가연성이 매우 크기 때문에 취급에 주의를 가해야 한다. 아세틸렌과 공기 또는 산소와의 혼합 가스는 넓은 폭발 한계를 가지고 있다. 공기 중에 2.5~81% 포함되어 있으면 폭발할 수 있다.
참고 문헌
[편집]- Considine, G. D., Van Nostrand's encyclopedia of chemistry, 5th edition, Hoboken : Wiley-Interscience, 2005.
- 성용길, 김창홍 역, 化學大辭典編集委員會 편, <<화학대사전>>, 서울: 世和, 2001.
- http://www.cjmillerllc.com/msds/Msdsonline%205.0/vault/000/000121.PDF[깨진 링크(과거 내용 찾기)]
각주
[편집]- ↑ 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 375쪽. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The name acetylene is retained for the compound HC≡CH. It is the preferred IUPAC name, but substitution of any kind is not allowed; however, in general nomenclature, substitution is allowed, for example fluoroacetylene [fluoroethyne (PIN)], but not by alkyl groups or any other group that extends the carbon chain, nor by characteristic groups expressed by suffixes.
- ↑ Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals, IUPAC Nomenclature of Organic Chemistry
- ↑ 가 나 다 라 NIOSH Pocket Guide to Chemical Hazards. “#0008”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ “Acetylene – Gas Encyclopedia Air Liquide”. 《Air Liquide》. 2022년 5월 4일에 원본 문서에서 보존된 문서. 2018년 9월 27일에 확인함.