Allylomlegging
Een allylomlegging, ook wel allylverschuiving genoemd, is een organische reactie waarin een dubbele binding in een allyverbinding doorschuift naar het volgende koolstofatoom. De omlegging treedt vooral op bij nucleofiele substitutiereacties.
In omstandigheden waarin een SN1-reactie makkelijk kan optreden vormt de allylverbinding een carbokation waarvoor twee resonantiestructuren mogelijk zijn. Deze resonantiestructuren verklaren ook de productverdeling na de reactie met een nucleofiel. De essentie van deze reactie is het tweestaps-mechanisme: eerst de unimoleculaire snelheidsbepalende vorming van het carbokation, gevolgd door de reactie met het nucleofiel.
Het alternatief voor de SN1-reactie vormt de SN2-reactie: het nucleofiel reageert geconcerteerd op de alylische positie, waarbij tegelijkertijd de leaving group de verbinding verlaat. Deze situatie treedt vooral op bij sterisch niet gehinderde allylgroepen in combinatie met een goed nucleofiel. Het verschil tussen de twee reactiemechanismen komt hier nauwelijks tot uiting in de gevormde producten. De reactie van 1-chloor-2-buteen met natriumhydroxide levert een mengsel van 2-buteen-1-ol en 1-buteen-3-ol, al vormt de aanwezigheid van het tweede isomeer wel een sterke aanwijzing dat er meer aan de hand is dan het eenvoudigweg vervangen van een chlooratoom door een hydroxylgroep:

Het product met de primaire alcoholfunctie wordt het minst gevormd. Bij de reactie van 1-chloor-3-methyl-2-buteen vormt het tertiaire 2-methyl-3-buten-2-ol 85% van het product, het primaire alcohol 3-methyl-2-buten-1-ol slechts 15%.
In bovenstaande reacties kan het product weliswaar omschreven worden met behulp van een allylomlegging, in feite vindt de reactie plaats aan een deeltje dat op twee plaatsen kan reageren. Het allyl-kation is op beide uiteinden positief geladen. Reactie op een van de plaatsen heeft tot gevolg dat de dubbele binding op een andere plek terechtkomt dan waar hij in de uitgangsverbinding zat. Een reactie waarbij een echte omlegging optreedt is de SN2'-reactie. Hier addeert het nucleofiel aan de dubbele binding en tegelijkertijd worden de elektronen van de dubbele binding verschoven in de richting van de leaving group, die vervolgens met zijn bindingselektronen de verbinding verlaat:

Voorbeelden
[bewerken | brontekst bewerken]Macrocyclische reactie
[bewerken | brontekst bewerken]De synthetische toepasbaarheid van de allylomlegging kan uitgebreid worden tot het butadieensysteem. Onderstaande reactie verloopt in methanol met di-isopropylethylamine als katalysator:[1]

In de eerste stap van deze macrocyclisatie wordt de thiolgroep aan het ene uiteinde van pentaan-1,5-dithiol gekoppeld aan het uiteinde van het butadieengedeelte van verbinding 1, waarbij enon 2 ontstaat. Tijdens deze reactie treedt de allylomlegging op, waarbij een sulfon als leaving group optreedt. Daarna reageert het andere einde van het dithiol in een additiereactie over een geconjugeerd systeem.
Dubbele allylomlegging
[bewerken | brontekst bewerken]Onderstaand voorbeeld laat een dubbele allylomlegging zien in één reactieserie:[2]

Tijdens deze serie reacties wordt via een Jacobson-epoxidatie een epoxide gevormd aan een dieen. Het zuurstofatoom van de epoxidering fungeert vervolgens als leaving group in een allylomlegging met pyrazool als nucleofiel. Het tweede nucleofiel is het Grignard-reagens methylmagnesiumbromide dat vervolgens de pyrazoolgroep verdringt.
Verborgen allylomlegging
[bewerken | brontekst bewerken]In onderstaand voorbeeld is de dubbele binding niet als zodanig aanwezig, maar verborgen onder de vorm van de aziridinering in combinatie met het broomatoom in de broommethylgroep (dit wordt een latente functionele groep genoemd). Een SN2'-reactie verklaart het reactieproduct dat ontstaat uit een aziridine met een broommethylgroep en methyllithium:[3]

.
In deze reactie ontstaat ook één equivalent ethyn.
Naamreacties
[bewerken | brontekst bewerken]Enkele voorbeelden van naamreacties waarin een allylomlegging optreedt:
SN2'-reductie
[bewerken | brontekst bewerken]Hoewel op zich genomen in het geheel van de SN2'-reactie waterstof in de vorm van hydride in de reactie als nucleofiel kan optreden, wordt in dat geval gesproken van SN2'-reductie. Een voorbeeld hiervan wordt beschreven in de totaalsynthese van taxol (de C-ring):[4]
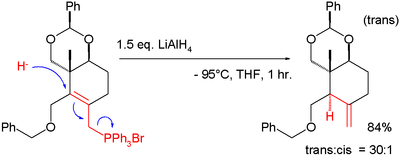
Het hydride is in dit geval afkomstig van lithiumaluminiumhydride. De leaving group is trifenylfosfine, dat in het uitgangsmateriaal als fosfoniumzout aanwezig is. In het reactieproduct is een exocyclische dubbele binding aanwezig. Alleen als de cyclohexaanring op de juiste wijze gesubstitueerd is, zal het nieuwe waterstofatoom in de juiste stereochemische relatie, namelijk trans ten opzichte van de op het daarnaastliggende koolstofatoom aanwezige methylgroep, komen te staan. De Whiting-reactie is op een gelijkstoortig reactiemechanisme gebaseerd.
Elektrofiele allylomlegging
[bewerken | brontekst bewerken]Doorgaans zijn allylomleggingen gebaseerd op het feit dat het allyl-kation door resonantie gestabiliseerd wordt, waardoor de omlegging met behulp van nucleofielen (negatief geladen of beschikkend over een vrij elektronenpaar) het meest voorkomt. Er zijn echter ook gevallen bekend van allylomleggingen onder invloed van elektrofielen. In het voorbeeld hieronder wordt de carbonylgroep van benzaldehyde voorafgaand aan de reactie met een aromatisch allylalcohol, geactiveerd door diboorzuur (Prins-reactie):[5]

De eigenlijke katalysator is een chelaatcomplex onder de vorm van een organopalladiumverbinding en p-tolueensulfonzuur. Het reactieproduct vormt zowel structureel als stereochemisch een zuiver isomeer. De reactie is echter ingewikkelder dan ze in eerste instantie lijkt, want naast de vorming van een nieuwe koolstof-koolstofbinding treedt er ook reductie op.
- ↑ Stephen J. Brocchini, Martin Eberle, and Richard G. Lawton. (1998). Molecular yardsticks. Synthesis of extended equilibrium transfer alkylating cross-link reagents and their use in the formation of macrocycles J. Amer. Chem. Soc.. 110 (15): pag.: 5211–5212 DOI:10.1021/ja00223a061
- ↑ A Ahmad El-Awa, Philip Fuchs. (2006). Double Lawton SN2' Addition to Epoxyvinyl Sulfones: Selective Construction of the Stereotetrads of Aplyronine Org. Lett.. 8 (14): pag.: 2905–2908 DOI:10.1021/ol060530l
- ↑ Matthias D'hooghe, Norbert De Kimpe. (2007). Highly unusual conversion of 1-alkyl-2-(bromomethyl)aziridines into 1-alkyl-2-(N-alkyl-N-ethylaminomethyl)aziridines using methyllithium Chem. Commun.. 2007 pag.: 1275–1277 DOI:10.1039/b616606g
- ↑ Masayuki Utsugi, Masayuki Miyano, Masahisa Nakada. (2006). Synthetic Studies on Taxol: Highly Stereoselective Construction of the Taxol C-Ring via SN2' Reduction of an Allylic Phosphonium Salt Org. Lett.. 8 (14): pag.: 2973–2976 DOI:10.1021/ol0608606
- ↑ Nicklas Selander, Sara Sebelius, Cesar Estay, Kálmán J. Szabó. (2006). Highly Selective and Robust Palladium-Catalyzed Carbon-Carbon Coupling between Allyl Alcohols and Aldehydes via Transient Allylboronic Acids Eur. J. Org. Chem.. 2006 (18): pag.: 4085–4087 DOI:10.1002/ejoc.200600530