Difosfaan
| Difosfaan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
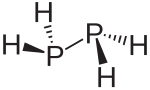
| ||||
Structuurformule van difosfaan
| ||||
| Algemeen | ||||
| Molecuulformule | P2H4 | |||
| IUPAC-naam | difosfaan | |||
| Andere namen | difosfine | |||
| Molmassa | 65,9788 g/mol | |||
| SMILES | PP
| |||
| CAS-nummer | 13445-50-6 | |||
| PubChem | 139283 | |||
| Wikidata | Q2442174 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Smeltpunt | −99 °C | |||
| Kookpunt | 52 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Difosfaan, vroeger bekend als difosfine, is een anorganische verbinding met de formule P2H4. Deze kleurloze vloeistof is een van de binaire fosfanen. In fosfine komt de stof als verontreiniging voor en is dan verantwoordelijk voor de spontane ontploffing van die stof als zij wordt blootgesteld aan lucht.
Synthese
[bewerken | brontekst bewerken]Difosfaan ontstaat tijdens de hydrolyse van calciummonofosfide (CaP). Volgens een geoptimaliseerde procedure is het mogelijk uit 400 gram CaP bij −30 °C ongeveer 20 gram difosfaan te verkrijgen. De stof is dan iets gecontamineerd met fosfine.[1]
Eigenschappen
[bewerken | brontekst bewerken]Difosfaan is een niet-basische, bij kamertemperatuur onstabiele verbinding die aan de lucht spontaan kan ontbranden. De stof lost slecht op in water, maar is goed oplosbaar in de standaard organische oplosmiddelen.
Derivaten
[bewerken | brontekst bewerken]Er is een groot aantal derivaten van difosfaan beschreven. Deze stoffen kunnen gesynthetiseerd worden door een reductieve koppeling, uitgaande van chloordifenylfosfine:
Tetramethyldifosfaan (P2Me4) ontstaat in de reactie van thiofosforylchloride met methylmagnesiumbromide.
In de reactie van methylmagnesiumjodide met thiofosfonylchloride ontstaat tetramethyldifosfinedisulfide .[2]
- ↑ Marianne Baudler, Klaus Glinka. (1993). Monocyclic and polycyclic phosphines Chem. Rev.. 93 pag.: 1623–1667 DOI:10.1021/cr00020a010
- ↑ G. W. Parshall "Tetramethylbiphosphine Disulfide" Org. Synth. 1965, volume 45, p. 102. DOI:10.15227/orgsyn.045.0102