Fritt elektronpar

I kjemi refererer et fritt elektronpar til et par valenselektroner som ikke er delt med et annet atom i en kovalent binding[1] og kalles noen ganger et udelt par eller ikke-bindende par. Frie elektronpar finnes i det ytterste elektronskallet til atomer. De kan identifiseres ved å bruke en Lewisstruktur. Elektronpar regnes derfor som frie elektronpar hvis to elektroner er sammenkoblet, men ikke brukes i kjemisk binding. Dermed er antall elektroner i det frie elektronparet pluss antall elektroner i bindinger lik antallet valenselektroner rundt et atom.
Frie elektronpar er et konsept som brukes i VSEPR-teorien som forklarer formene til molekyler. De er også referert til i kjemien til Lewis-syrer og baser. Imidlertid anses ikke alle ikke-bindende elektronpar av kjemikere for å være frie elektronpar. Eksempler er innskuddsmetallene der de ikke-bindende parene ikke påvirker molekylær geometri og sies å være stereokjemisk inaktive. I molekylær orbitalteori (fullstendig delokaliserte kanoniske orbitaler eller lokalisert i en eller annen form), er konseptet med et fritt elektronpar mindre distinkt, ettersom samsvaret mellom en orbital og komponenter i en Lewis-struktur ofte ikke er enkel. Ikke desto mindre blir okkuperte ikke-bindende orbitaler (eller orbitaler av stort sett ikke-bindende karakter) ofte identifisert som frie elektronpar.
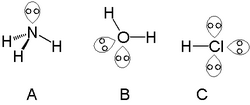
Et enkelt fritt elektronpar kan bli funnet i atomer i nitrogengruppen, slik som nitrogen i ammoniakk. To frie elektronpar kan finnes med atomer i kalkogengruppen, for eksempel oksygen i vann. Halogenene kan bære tre frie elektronpar, for eksempel i hydrogenklorid.
I VSEPR-teorien danner elektronparene på oksygenatomet i vann toppunktene til et tetraeder med de frie elektronparene på to av de fire toppunktene. H–O–H-bindingsvinkelen er 104,5°, mindre enn 109° forutsagt for en tetraedrisk vinkel, og dette kan forklares med en frastøtende interaksjon mellom de frie elektronparene.[2][3][4]
Ulike beregningskriterier for tilstedeværelsen av frie elektronpar har blitt foreslått. Mens elektrontettheten ρ(r) i seg selv generelt ikke gir nyttig veiledning i denne forbindelse, er Laplacian for elektrontettheten avslørende, og ett kriterium for plasseringen av det frie elektronparet er hvor L(r) = –∇2ρ(r) er et lokalt maksimum. Minimaet for det elektrostatiske potensialet V(r) er et annet foreslått kriterium. Enda en tar for seg elektronlokaliseringsfunksjonen (ELF).[5]
Referanser
[rediger | rediger kilde]- ^ Chemistry (IUPAC), The International Union of Pure and Applied. «IUPAC - lone (electron) pair (L03618)». goldbook.iupac.org. Besøkt 20. juni 2022.
- ^ Fox, Marye Anne (2004). Organic chemistry (3rd ed utg.). Sudbury, Mass.: Jones and Bartlett Publishers. ISBN 0-7637-2197-2. OCLC 52553798.
- ^ McMurry, John (2000). Organic Chemistry 5th Ed. (på engelsk). Ceneage Learning India Pvt Limited. ISBN 978-81-315-0039-2.
- ^ Lee, John David (1968). Concise Inorganic Chemistry (på engelsk). Van Nostrand.
- ^ Kumar, Anmol; Gadre, Shridhar R.; Mohan, Neetha; Suresh, Cherumuttathu H. (16. januar 2014). «Lone pairs: an electrostatic viewpoint». The Journal of Physical Chemistry. A. 2. 118: 526–532. ISSN 1520-5215. PMID 24372481. doi:10.1021/jp4117003. Besøkt 20. juni 2022.