Batrachochytrium dendrobatidis
| Batrachochytrium dendrobatidis | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
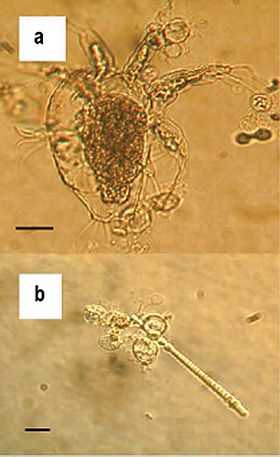 Zoosporangia de B. dendrobatidis crescendo em artrópodes de água doce (a) e algas (b); barras de escala = 30 µm | |||||||||||||||
| Classificação científica | |||||||||||||||
| |||||||||||||||
| Nome binomial | |||||||||||||||
| Batrachochytrium dendrobatidis Longcore, Pessier & D.K. Nichols, 1999 | |||||||||||||||
Batrachochytrium dendrobatidis, também conhecido como Bd ou fungo quítrido anfíbio, é um fungo que causa a doença quitridiomicose em anfíbios. Desde sua descoberta em 1998 por Lee Berger,[1] a doença devastou populações de anfíbios em todo o mundo, num declínio global que provocou múltiplas extinções, parte da extinção do Holoceno. Uma segunda espécie recentemente descrita, B. salamandrivorans, também causa quitridiomicose e morte em salamandras. Consta em décimo terceiro na lista das 100 das espécies exóticas invasoras mais daninhas do mundo da União Internacional para a Conservação da Natureza (UICN)[2]
Os patógenos fúngicos que causam a doença quitridiomicose devastam a pele de rãs, sapos e outros anfíbios, prejudicando seu equilíbrio de água e sal e, eventualmente, causando insuficiência cardíaca, relata a Nature. Algumas espécies de anfíbios parecem ter capacidade inata de resistir à infecção por quitridiomicose devido à simbiose com Janthinobacterium lividum. Mesmo dentro de espécies que geralmente sucumbem, algumas populações sobrevivem, possivelmente demonstrando que esses traços ou alelos de espécies estão sendo submetidos à seleção evolutiva.
Etimologia
[editar | editar código-fonte]O nome genérico é derivado das palavras gregas batrachos (sapo) e chytra (panela de barro), enquanto o epíteto específico é derivado do gênero de rãs do qual a confirmação original da patogenicidade foi feita (Dendrobates),[3] dendrobatidis é do grego dendron, "árvore", e bates, "aquele que escala", referindo-se a um gênero de sapos venenosos.[4]
Sistemática
[editar | editar código-fonte]Batrachochytrium dendrobatidis foi até recentemente considerada a única espécie do gênero Batrachochytrium. A classificação inicial do patógeno como quitrídio foi baseada na ultraestrutura dos zoósporos. A análise de DNA do SSU-rDNA corroborou a visão, com a correspondência mais próxima de Chytridium confervae. Uma segunda espécie de Batrachochytrium foi descoberta em 2013: B. salamandrivorans, que afeta principalmente salamandras e também causa quitridiomicose.[4] B. salamandrivorans difere de B. dendrobatidis principalmente na formação de tubos germinativos in vitro, na formação de talos coloniais com múltiplos esporângios in vivo e uma menor preferência térmica.[5]
Morfologia
[editar | editar código-fonte]B. dendrobatidis infecta a pele queratinizada de anfíbios. O fungo na epiderme tem talo com rede de rizoides e esporângios de paredes lisas, aproximadamente esféricas, inoperculadas (sem opérculo). Cada esporângio produz um único tubo para descarregar os esporos.
Estrutura do zoósporo
[editar | editar código-fonte]Zoósporos de B. dendrobatidis, que são tipicamente de três a cinco micrômetros de tamanho, têm corpo alongado-ovoidal com único flagelo posterior (19 a 20 micrômetros de comprimento) e possuem área central de ribossomos, muitas vezes com esferas de membrana de ribossomos dentro da massa ribossomal principal. Um pequeno esporão foi observado, localizado na parte posterior do corpo celular, adjacente ao flagelo, mas isso pode ser um artefato nos espécimes fixados em formalina. A área central dos ribossomos é circundada por uma única cisterna de retículo endoplasmático, duas a três mitocôndrias e um extenso complexo microcorpo-glóbulo lipídico. Os microcorpos se aproximam e cercam quase quatro a seis glóbulos lipídicos (três anteriores e um a três lateralmente), alguns dos quais parecem ligados por uma cisterna. Alguns zoósporos parecem conter mais glóbulos lipídicos (isso pode ter sido resultado dum efeito de plano de corte, porque os glóbulos eram frequentemente lobados nos zoósporos examinados). Um rumposomo não foi observado.[3]
Estrutura do flagelo
[editar | editar código-fonte]Um centríolo que não funciona fica adjacente ao cinetossomo. Nove adereços interligados prendem o cinetossomo ao plasmalema e uma placa terminal está presente na zona de transição. Uma estrutura interna semelhante a um anel ligado aos túbulos dos dubletos flagelares dentro da zona de transição foi observada em seção transversal. Não foram observadas raízes associadas ao cinetossomo. Em muitos zoósporos, o núcleo encontra-se parcialmente dentro da agregação de ribossomos e estava invariavelmente situado lateralmente. Pequenos vacúolos e um corpo de Golgi com cisternas empilhadas ocorreram dentro do citoplasma fora da área ribossomal. As mitocôndrias, que geralmente contêm pequeno número de ribossomos, são densamente coradas com cristas discoides.[3]
Ciclo de vida
[editar | editar código-fonte]

B. dendrobatidis tem dois estágios de vida primários: um zoosporângio reprodutivo séssil e um zoósporo móvel, uniflagelado liberado do zoosporângio. Os zoósporos são conhecidos por serem ativos apenas por curto período de tempo e podem percorrer distâncias curtas de um a dois centímetros.[6] No entanto, os zoósporos são capazes de quimiotaxia e podem se mover em direção a uma variedade de moléculas que estão presentes na superfície dos anfíbios, como açúcares, proteínas e aminoácidos.[7] B. dendrobatidis também contém uma variedade de enzimas proteolíticas e esterases que ajudam a digerir células de anfíbios e usar a pele deles como fonte de nutrientes.[8] Uma vez que o zoósporo atinge seu hospedeiro, forma um cisto sob a superfície da pele e inicia a porção reprodutiva de seu ciclo de vida. Os zoósporos encistados se desenvolvem em zoosporângios, que podem produzir mais zoósporos que podem reinfectar o hospedeiro ou serem liberados no ambiente aquático circundante.[9] Os anfíbios infectados com esses zoósporos morrem de parada cardíaca.[10] Além dos anfíbios, B. dendrobatidis também infecta lagostins (Procambarus alleni, P. clarkii, Orconectes virilis e O. immunis), mas não mosquitos (Gambusia holbrooki).[11]
Fisiologia
[editar | editar código-fonte]B. dendrobatidis pode crescer dentro de ampla faixa de temperatura (4-25 °C), com temperaturas ideais entre 17 e 25 °C. A ampla faixa de temperatura ao crescimento, incluindo a capacidade de sobreviver a 4 °C, dá ao fungo a capacidade de hibernar em seus hospedeiros, mesmo onde as temperaturas nos ambientes aquáticos são baixas. A espécie não cresce bem acima de temperaturas de 25 °C, e o crescimento é interrompido acima de 28 °C.[12] As rãs Litoria chloris infectadas se recuperaram de suas infecções quando incubadas a uma temperatura de 37 °C.[13]
Formas variadas
[editar | editar código-fonte]B. dendrobatidis foi ocasionalmente encontrado em formas distintas de seus estágios tradicionais de zoósporos e esporângios. Por exemplo, antes da onda de calor europeia de 2003 que dizimou populações do sapo aquático Rana Lessonae através da quitridiomicose, o fungo existia nos anfíbios como organismos unicelulares esféricos, confinados a pequenas manchas (80-120 micrômetros de diâmetro). Esses organismos, desconhecidos na época, foram posteriormente identificados como B. dendrobatidis. As características dos organismos eram sugestivas de zoósporos encistados; podem ter incorporado um esporo em repouso, um sapróbio ou uma forma parasita do fungo que não é patogênico.[14]
Habitat e relacionamento com anfíbios
[editar | editar código-fonte]O fungo cresce na pele dos anfíbios e produz zoósporos aquáticos.[15] É generalizada e varia de florestas de planície a topos de montanhas frias. Às vezes é um parasita não letal e possivelmente um saprófita. O fungo está associado à mortalidade do hospedeiro em terras altas ou durante o inverno e se torna mais patogênico em temperaturas mais baixas.[16]
Distribuição geográfica
[editar | editar código-fonte]
Tem sido sugerido que B. dendrobatidis se originou na África ou na Ásia e posteriormente se espalhou para outras partes do mundo pelo comércio de rãs Xenopus laevis. Neste estudo, foram examinados 697 espécimes arquivados de três espécies de Xenopus, previamente coletados de 1879 a 1999 na África Austral. O caso mais antigo de quitridiomicose foi encontrado num espécime de X. laevis de 1938. O estudo também sugere que a quitridiomicose era uma infecção estável no sul da África desde 23 anos antes de encontrar qualquer infecção fora da África.[17] Há informações mais recentes de que a espécie se originou na península Coreana e se espalhou pelo comércio de rãs.[18]
As rãs Lithobates catesbeianus, também amplamente distribuídas, são consideradas portadoras da doença devido à sua baixa suscetibilidade inerente à infecção por B. dendrobatidis.[19][20] A L. catesbeianus geralmente escapa do cativeiro e pode estabelecer populações selvagens onde pode introduzir a doença em novas áreas.[6] Também foi demonstrado que B. dendrobatidis pode sobreviver e crescer em solo úmido e em penas de pássaros, sugerindo que B. dendrobatidis também pode ser disseminado no ambiente por pássaros e transporte de solos.[21] As infecções têm sido associadas à mortalidade em massa de anfíbios na América do Norte, América do Sul, América Central, Europa e Austrália.[22][23][24] B. dendrobatidis tem sido implicado na extinção da rã Taudactylus acutirostris na Austrália.[25]
Uma grande variedade de hospedeiros anfíbios foi identificada como sendo suscetível à infecção por B. dendrobatidis, incluindo Lithobates sylvatica,[26] Lithobates muscosa,[27] Eurycea cirrigera,[28] Eurycea nana, Eurycea neotenes, Eurycea pterophila, Eurycea sosorum, Eurycea tonkawae,[29] Ambystoma jeffersonianum,[30] Pseudacris triseriata, Acris gryllus, Scaphiopus holbrooki, Lithobates sphenocephala,[31] Lithobates berlandieri,[32] Euproctus platycephalus[33] e espécies de rãs endêmicas, Pelophylax caralitanus.[34]
Sudeste Asiático
[editar | editar código-fonte]Embora a maioria dos estudos sobre B. dendrobatidis tenha sido realizada em vários locais do mundo, a presença do fungo no Sudeste Asiático continua sendo um desenvolvimento relativamente recente. O processo exato pelo qual o fungo foi introduzido na Ásia não é conhecido, no entanto, como mencionado acima, tem sido sugerido o transporte de espécies portadoras assintomáticas (por exemplo, Lithobates catesbeianus) pode ser um componente chave na disseminação do fungo, pelo menos na China.[35] Estudos iniciais demonstraram a presença do fungo em estados/países insulares como Honguecongue,[36] Indonésia,[37] Taiuã[31] e Japão.[38] Logo depois, países da Ásia continental, como Tailândia,[39] Coreia do Sul[40] e China[41] relataram incidências de B. dendrobatidis entre suas populações de anfíbios.
No Camboja, um estudo mostrou que B. dendrobatidis é prevalente em todo o país em áreas próximas a Penome Pene (em uma vila <5 quilômetros), Sihanoukville (rãs coletadas no mercado local), Kratie (rãs coletadas nas ruas ao redor da cidade), e Siem Reap (rãs coletadas de uma reserva nacional: Centro de Conservação da Biodiversidade de Angkor).[42] Outro estudo no Camboja questionou o potencial impacto antropológico na disseminação de B. dendrobatidis em populações locais de anfíbios em três áreas diferentes em relação à interação humana: baixo (uma floresta isolada no topo de uma montanha raramente visitada), médio (uma estrada florestal ~15 quilômetros de uma vila que é usada pelo menos uma vez por semana) e alta (uma pequena vila onde os humanos interagem com o ambiente diariamente). Usando PCR quantitativo, a evidência de B. dendrobatidis foi encontrada em todos os três locais com a maior porcentagem de anfíbios positivos para o fungo da estrada florestal (impacto médio; 50%), seguido pela floresta de montanha (baixo impacto; 44%) e vila (alto impacto; 36%).[43] A influência humana provavelmente explica a detecção do fungo nas áreas médias e altas, porém não fornece uma explicação adequada porque mesmo anfíbios isolados foram positivos para B. dendrobatidis. Isso pode ficar sem resposta até que mais pesquisas sejam realizadas sobre a transmissão do fungo através das paisagens. No entanto, evidências recentes sugerem que os mosquitos podem ser um possível vetor que pode ajudar a espalhar B. dendrobatidis. Outro estudo na Guiana Francesa relata infecção generalizada, com 8 dos 11 locais amostrados sendo positivos para infecção por B. dendrobatidis para pelo menos uma espécie.[44]
Efeitos em anfíbios
[editar | editar código-fonte]
As populações de anfíbios em todo o mundo estão em constante declínio devido ao aumento da doença quitridiomicose, causada pelo fungo Bd. O Bd pode ser introduzido num anfíbio principalmente através da exposição à água, colonizando os dedos e as superfícies ventrais do corpo do animal mais fortemente e se espalhando por todo o corpo à medida que o animal amadurece. Os efeitos potenciais desse patógeno são hiperqueratose, hiperplasia epidérmica, úlceras e, mais proeminentemente, a alteração na regulação osmótica, muitas vezes levando à parada cardíaca.[45] O número de mortos em anfíbios depende duma variedade de fatores, mas mais crucialmente da intensidade da infecção. Descobriu-se que algumas espécies de anfíbios se adaptam à infecção após uma morte inicial, com taxas de sobrevivência iguais de indivíduos infectados e não infectados.[46]
De acordo com um estudo da Universidade Nacional da Austrália, estima-se que o fungo Bd tenha causado o declínio de 501 espécies de anfíbios – cerca de 6,5% do total conhecido no mundo. Destas, 90 foram totalmente exterminadas e outras 124 espécies diminuíram em mais de 90%, e as chances das espécies afetadas se recuperarem para uma população saudável são duvidosas.[47] No entanto, essas conclusões foram criticadas por estudos posteriores, que propuseram que o Bd não era fator primário de declínio de anfíbios como encontrado pelo estudo anterior.[48]
Referências
- ↑ Berger, L.; Speare, R; Daszak, P.; Green, D. E.; Cunningham, A. A.; Goggin, C. L.; Slocombe, R.; Ragan, M. A.; Hyatt, A. D.; McDonald, K. R.; Hines, H. B.; Lips, K. R.; Marantelli, G.; Parkes, H. (julho de 1998). «Chytridiomycosis causes amphibian mortality associated with population declines in the rain forests of Australia and Central America». Proceedings of the National Academy of Sciences of the United States of America. 95 (15): 9031–6. Bibcode:1998PNAS...95.9031B. PMC 21197
 . PMID 9671799. doi:10.1073/pnas.95.15.9031
. PMID 9671799. doi:10.1073/pnas.95.15.9031
- ↑ Lowe, S.; Browne, M.; Boudjelas, S.; Poorter, M. (2004) [2000]. «100 of the World's Worst Invasive Alien Species: A selection from the Global Invasive Species Database» (PDF). Auclanda: O Grupo de Especialistas em Espécies Invasoras (ISSG), um grupo de especialistas da Comissão de Sobrevivência de Espécies (SSC) da União Mundial de Conservação (IUCN). Consultado em 21 de outubro de 2022. Cópia arquivada (PDF) em 16 de março de 2017
- ↑ a b c Longcore, J. E.; Pessier, A. P.; Nichols, D. K. (1999). «Batrachochytrium Dendrobatidis gen. et sp. nov, a chytrid pathogenic to amphibians». Mycologia. 91 (2): 219–227. JSTOR 3761366. doi:10.2307/3761366
- ↑ «Etymologia: Batrachochytrium salamandrivorans». Emerg Infect Dis. 22 (7): 1282. Julho de 2016. PMC 4918143
 . doi:10.3201/eid2207.ET2207
. doi:10.3201/eid2207.ET2207
- ↑ Martel, A.; Spitzen-van der Sluijs, A.; Blooi, M.; Bert, W.; Ducatelle, R.; Fisher, M. C.; Woeltjes, A.; Bosman, W.; Chiers, K.; Bossuyt, F.; Pasmans, F. (2013). «Batrachochytrium salamandrivorans sp. nov. causes lethal chytridiomycosis in amphibians». Proceedings of the National Academy of Sciences of the United States of America. 110 (38): 15325–15329. Bibcode:2013PNAS..11015325M. PMC 3780879
 . PMID 24003137. doi:10.1073/pnas.1307356110
. PMID 24003137. doi:10.1073/pnas.1307356110
- ↑ a b Garner, T. W.; Perkins, M. W.; Govindarajulu, P.; Seglie, D.; Walker, S.; Cunningham, A. A.; Fisher, M. C. (setembro de 2006). «The emerging amphibian pathogen Batrachochytrium dendrobatidis globally infects introduced populations of the North American bullfrog, Lithobates catesbeiana». Biol. Lett. 2 (3): 455–9. PMC 1686185
 . PMID 17148429. doi:10.1098/rsbl.2006.0494 [ligação inativa]
. PMID 17148429. doi:10.1098/rsbl.2006.0494 [ligação inativa]
- ↑ Moss, A. S.; Reddy, N. S.; Dortaj, I. M.; San Francisco, M. J. (2008). «Chemotaxis of the amphibian pathogen Batrachochytrium dendrobatidis and its response to a variety of attractants». Mycologia. 100 (1): 1–5. PMID 18488347. doi:10.3852/mycologia.100.1.1
- ↑ Symonds, E. P.; Trott, D. J.; Bird, P. S.; Mills, P. (2008). «Growth characteristics and enzyme activity in Batrachochytrium dendrobatidis isolates». Mycopathologia. 166 (3): 143–147. PMID 18568420. doi:10.1007/s11046-008-9135-y
- ↑ Berger, L.; Hyatt, A. D.; Speare, R.; Longcore, J. E. (dezembro de 2005). «Life cycle stages of the amphibian chytrid Batrachochytrium dendrobatidis». Dis. Aquat. Org. 68 (1): 51–63. PMID 16465834. doi:10.3354/dao068051

- ↑ Voyles, J.; Young, S.; Berger, L.; Campbell, C.; Voyles, W. F.; Dinudom, A.; Cook, D.; Webb, R.; Alford, R. A.; Skerratt, L. F.; Speare, R. (2009). «Pathogenesis of chytridiomycosis, a cause of catastrophic amphibian declines». Science. 326 (5952): 582–585. Bibcode:2009Sci...326..582V. PMID 19900897. doi:10.1126/science.1176765
- ↑ McMahon, T. A.; Brannelly, L. A.; Chatfield, M. W.; Johnson, P. T.; Joseph, M. B.; McKenzie, V. J.; Richards-Zawacki, C. L.; Venesky, M. D.; Rohr, J. R. (2013). «Chytrid fungus Batrachochytrium dendrobatidis has nonamphibian hosts and releases chemicals that cause pathology in the absence of infection." Proceedings of the National Academy of Sciences 110.1 (2013): 210-215. Web. 01 Nov. 2020.». Proceedings of the National Academy of Sciences of the United States of America. 110 (1): 210–5. PMC 3538220
 . PMID 23248288. doi:10.1073/pnas.1200592110
. PMID 23248288. doi:10.1073/pnas.1200592110
- ↑ Piotrowski, J. S.; Annis, S.; Longcore, J. E. (2004). «Physiology of Batrachochytrium dendrobatidis, a chytrid pathogen of amphibians». Mycologia. 96 (1): 9–15. JSTOR 3761981. PMID 21148822. doi:10.2307/3761981
- ↑ Woodhams, D. C.; Alford, R. A.; Marantelli, G. (junho de 2003). «Emerging disease of amphibians cured by elevated body temperature». Dis. Aquat. Org. 55 (1): 65–7. PMID 12887256. doi:10.3354/dao055065

- ↑ Di Rosa, Ines; Simoncelli, Francesca; Fagotti, Anna; Pascolini, Rita (2007). «The Proximate Cause of Frog Declines?». Nature. 447 (7144): E4–E5. Bibcode:2007Natur.447....4R. PMID 17538572. doi:10.1038/nature05941
- ↑ Ron, S. R. (2005). «Predicting the Distribution of the Amphibian Pathogen B. dendrobatidis in the New World». Biotropica. 37 (2): 209–221. doi:10.1111/j.1744-7429.2005.00028.x
- ↑ Daszak, P.; Cuningham, A. A.; Hyatt, A. D. (2003). «Infection disease and amphibian population declines». Divers. Distrib. 9 (2): 141–150. doi:10.1046/j.1472-4642.2003.00016.x
- ↑ Weldon, C.; du Preez, L. H.; Hyatt, A. D.; Muller, R.; Spears, R. (dezembro de 2004). «Origin of the amphibian chytrid fungus». Emerging Infect. Dis. 10 (12): 2100–5. PMC 3323396
 . PMID 15663845. doi:10.3201/eid1012.030804
. PMID 15663845. doi:10.3201/eid1012.030804
- ↑ «Frog-Killing Fungus Found to Have Origins on Korean Peninsula». The New York Times (em inglês). 10 de maio de 2018. ISSN 0362-4331. Consultado em 10 de outubro de 2022. Cópia arquivada em 29 de agosto de 2022
- ↑ Kats, L. B.; Ferrer, R. P. (2003). «Alien predators and amphibian declines: review of two decades of science and the transition to conservation». Diversity and Distributions. 9 (2): 99–110. doi:10.1046/j.1472-4642.2003.00013.x
- ↑ Daszak, P; Strieby, A.; Cunningham, A. A.; Longcore, J. E.; Brown, C. C.; Porter, D. (2004). «Experimental evidence that the bullfrog (Rana catesbeiana) is a potential carrier of chytridiomycosis, an emerging fungal disease of amphibians». Herpetological Journal. 14: 201–207
- ↑ Johnson, M. L.; Speare, R. (julho de 2005). «Possible modes of dissemination of the amphibian chytrid Batrachochytrium dendrobatidis in the environment» (PDF). Dis. Aquat. Org. 65 (3): 181–6. PMID 16119886. doi:10.3354/dao065181
 . Cópia arquivada (PDF) em 6 de outubro de 2022
. Cópia arquivada (PDF) em 6 de outubro de 2022
- ↑ Lips, K. R. (1999). «Mass mortality and population declines of anurans at an upland site in western Panama». Conservation Biology. 13 (1): 117–125. doi:10.1046/j.1523-1739.1999.97185.x
- ↑ Daszak, P.; Cunningham, A. A.; Hyatt, A. D. (2003). «Infectious disease and amphibian population declines» (PDF). Diversity and Distributions. 9 (2): 141–50. doi:10.1046/j.1472-4642.2003.00016.x. Arquivado do original (PDF) em 26 de dezembro de 2008
- ↑ Herrera, R. A.; Steciow, M. M.; Natale, G. S. (2005). «Chytrid fungus parasitizing the wild amphibian Leptodactylus ocellatus (Anura: Leptodactylidae) in Argentina». Diseases of Aquatic Organisms. 64 (3): 247–52. PMID 15997823. doi:10.3354/dao064247

- ↑ Schloegel, L. M.; Hero, J. M.; Berger, L.; Speare, R.; McDonald, K.; Daszak, P. (2006). «The decline of the sharp-snouted day frog (Taudactylus acutiostris): the first documented case of extinction by infection in a free-ranging wildlife species?». EcoHealth. 3: 35–40. CiteSeerX 10.1.1.602.3591
 . doi:10.1007/s10393-005-0012-6
. doi:10.1007/s10393-005-0012-6
- ↑ Reeves, M. K. (2008). «Batrachochytrium dendrobatidis in wood frogs (Lithobates sylvatica) from Three National Wildlife Refuges in Alaska, USA». Herpetological Review. 39 (1): 68–70
- ↑ Andre, S. E.; Parker, J.; Briggs, C. J. (2008). «Effect of temperature on host response to Batrachochytrium dendrobatidis infection in the mountain yellow-legged frog (Lithobates muscosa)». Journal of Wildlife Diseases. 44 (3): 716–720. PMID 18689660. doi:10.7589/0090-3558-44.3.716

- ↑ Byrne, M. W.; Davie, E. P.; Gibbons, J. W. (2008). «Batrachochytrium dendrobatidis occurrence in Eurycea cirrigera». Southeastern Naturalist. 7 (3): 551–555. doi:10.1656/1528-7092-7.3.551
- ↑ Gaertner, J. P.; Forstner, M. R.; O'Donnell, L.; Hahn, D. (2009). «Detection of Batrachochytrium dendrobatidis in endemic salamander species from Central Texas». EcoHealth. 6 (1): 20–26. PMID 19424755. doi:10.1007/s10393-009-0229-x
- ↑ Brodman, R.; Briggler, J. T. (2008). «Batrachochytrium dendrobatidis in Ambystoma jeffersonianum larvae in southern Indiana». Herpetological Review. 39 (3): 320–321
- ↑ a b Lehtinen, R. M.; Kam, Y.-C.; Richards, C. L. (2008). «Preliminary surveys for Batrachochytrium dendrobatidis in Taiwan». Herpetological Review. 39 (3): 317–318
- ↑ Lovich, R.; Ryan, M. J.; Pessier, A. P.; CLaypool, B. (2008). «Infection with the fungus Batrachochytrium dendrobatidis in a non-native Lithobates berlandieri below sea level in the Coachella Valley, California, USA». Herpetological Review. 39 (3): 315–317
- ↑ Bovero, S.; Sotgiu, G.; Angelini, C.; Doglio, S.; Gazzaniga, E.; Cunningham, A. A.; Garner, T. W. (2008). «Detection of chytridiomycosis caused by Batrachochytrium dendrobatidis in the endangered sardinian newt (Euproctus platycephalus), in Southern Sardinia, Italy». Journal of Wildlife Diseases. 44 (3): 712–715. PMID 18689659. doi:10.7589/0090-3558-44.3.712

- ↑ Erismis, U. C.; Konuk, M.; Yoldas, T.; Agyar, P.; Yumuk, D.; Korcan, S. E. (2014). «Survey of Turkey's endemic amphibians for chytrid fungus Batrachochytrium dendrobatidis, in Turkey» (PDF). Journal of Wildlife Diseases. 111 (2): 153–157. PMID 25266902. doi:10.3354/dao02742
 . Cópia arquivada (PDF) em 20 de março de 2022
. Cópia arquivada (PDF) em 20 de março de 2022
- ↑ Bai, C.; Garner, T. W.; Li, Y. (2010). «First evidence of Batrachochytrium dendrobatidis in China: discovery of chytridiomycosis in introduced American bullfrogs and native amphibians in the Yunnan Province, China». Dis Aquat Org. 92 (1): 241–244. PMID 20372969. doi:10.1007/s10393-010-0307-0
- ↑ Rowley, J.; Chan, S. K.; Tang, W. S.; Speare, R.; Skerratt, L. F.; Alford, R. A.; Cheung, K. S.; Ho, C. Y.; Campbell, R. (2007). «Survey for the amphibianchytrid Batrachochytrium dendrobatidis in Hong Kong in native amphibians and in the international amphibian trade». Diseases of Aquatic Organisms. 78 (2): 87–95. PMID 18286805. doi:10.3354/dao01861

- ↑ Kusrini, M. D.; Skerratt, L. F.; Garland, S.; Berger, L.; Endarwin, W (2008). «Chytridiomycosis in frogs of Mount Gede Pangrango, Indonesia» (PDF). Diseases of Aquatic Organisms. 82 (3): 187–194. PMID 19244970. doi:10.3354/dao01981
 . Cópia arquivada (PDF) em 6 de outubro de 2022
. Cópia arquivada (PDF) em 6 de outubro de 2022
- ↑ Fisher, M. C.; Garner, T. W.; Walker, S. F. (2009). «Global emergence of Batrachochytrium dendrobatidis and amphibian chytridiomycosis inspace, time, and host». Annual Review of Microbiology. 63: 291–310. PMID 19575560. doi:10.1146/annurev.micro.091208.073435
- ↑ McLeod, D. S.; Sheridan, J. A.; Jiraungkoorskul, W.; Khonsue, W. (2008). «A survey for chytrid fungus in Thai amphibians». Raffles Bulletin of Zoology. 56: 199–204
- ↑ Yang, H.; Baek, H.; Speare, R.; Webb, R.; Park, S.; Kim, T.; Lasat, K. C.; Shin, S.; Son, S.; Park, J.; Min, M.; Kim, Y.; Na, K.; Lee, H.; Park, S. (2008). «First detection of the amphibian chytrid fungus Batrachochytrium dendrobatidis in free-ranging populations of amphibians on mainland Asia: survey in South Korea». Dis Aquat Org. 86 (1): 9–13. PMID 19899344. doi:10.3354/dao02098

- ↑ Wei, Y.; Xu, K.; Zhu, D.-Z.; Chen, X.-F.; Wang, X.-L. (2010). «First Early-spring survey for Batrachochytrium dendrobatidis in wild Rana dybowskii in Heilongjiang Province, China». Dis Aquat Org. 92 (3): 241–244. PMID 21268987. doi:10.3354/dao02172

- ↑ Gaertner, J. P.; Mendoza, J. A.; Forstner, M. R.; Neang, T.; Hahn, D. (2011). «Detection of Batrachochytrium dendrobatidis in frogs from different locations in Cambodia». Herpetological Review. 42: 546–548
- ↑ Mendoza, J. A.; Gaertner, J. P.; Holden, J.; Forstner, M. R.; Hahn, D. (2011). «Detection of Batrachochytrium dendrobatidis on amphibians in Pursat Province, Cambodia». Herpetological Review. 42: 542–545
- ↑ Courtois, E. A.; Gaucher, P.; Chave, J.; Schmeller, D. S. (2015). «Widespread Occurrence of Bd in French Guiana, South America». PLOS ONE. 10 (4): e0125128. Bibcode:2015PLoSO..1025128C. PMC 4406614
 . PMID 25902035. doi:10.1371/journal.pone.0125128
. PMID 25902035. doi:10.1371/journal.pone.0125128
- ↑ «Chytridiomycosis». www.amphibiaweb.org. Consultado em 27 de maio de 2016. Cópia arquivada em 4 de agosto de 2022
- ↑ DiRenzo, Graziella; Zipkin, Elise; Grant, Evan Campbell; Royle, J. Andrew; Longo, Ana; Zamudio, Kelly; Lips, Karen (3 de outubro de 2018). «Eco‐evolutionary rescue promotes host–pathogen coexistence». Ecological Applications. 28 (8): 1948–1962. PMID 30368999. doi:10.1002/eap.1792

- ↑ Yong, Ed (28 de março de 2019). «The Worst Disease Ever Recorded». The Atlantic. Consultado em 28 de março de 2019. Cópia arquivada em 31 de julho de 2021
- ↑ Lambert, Max R.; Womack, Molly C.; Byrne, Allison Q.; Hernández-Gómez, Obed; Noss, Clay F.; Rothstein, Andrew P.; Blackburn, David C.; Collins, James P.; Crump, Martha L.; Koo, Michelle S.; Nanjappa, Priya (20 de março de 2020). «Comment on "Amphibian fungal panzootic causes catastrophic and ongoing loss of biodiversity"». Science (em inglês). 367 (6484): eaay1838. ISSN 0036-8075. PMID 32193293. doi:10.1126/science.aay1838

Bibliografia
[editar | editar código-fonte]- Berger, L.; Speare, R. (1998). «Chytridiomycosis: a new disease of wild and captive amphibians». ANZCCART Newsletter. 11 (4): 1-3
- Blaustein, A. R.; Dobson A. (2006). «A message from the frogs». Nature. 439: 143-144
- Pounds, A. J.; Bustamante, M. R.; Coloma, L. A.; Consuegra, J. A.; Fogden, M. P. L.; Foster, P. N.; la Marca, E.; Masters, K. L.; Merino-Viteri, A.; Puschendorf, R.; Ron, S. R.; Sanchez-Azofeifa, G. A.; Still, C. J.; Young, B. E. (2006). «Widespread amphibian extinctions from epidemic disease driven by global warming». Nature. 439: 161-167
- Stuart, S. N.; Chanson, J. S.; Cox, N. A.; Youn, B. E.; Rodrigues, A. S. L.; Fischman, Waller R. W. (2004). «Status and trends of amphibian declines and extinctions worldwide». Science. 306: 1783-1786