Epóxido


Um epóxi é um éter cíclico com três átomos que formam um anel. Este anel define aproximadamente um triângulo equilátero que o torna altamente tenso. Esse anel sob tensão torna o epóxi mais reactivo que os outros éteres. Os epóxis simples são nomeados a partir do composto original óxido de etileno ou oxirano tal como o clorometiloxirano. Como grupo funcional, os epóxis apresentam o prefixo epoxi-, tal como no composto 1,2-epoxiciclo-heptano que também pode ser chamado de ciclo-hepatno epóxi.

Um polímero que contém grupos epóxis por reagir é chamado poliepóxi. As resinas epóxi são usadas como adesivos ou materiais estruturais. A polimerização de um epóxi produz um poliéter — por exemplo, o óxido de etileno polimeriza para produzir polietileno glicol, também conhecido por óxido de polietileno —.
Síntese
[editar | editar código-fonte]Os epóxidos dominantes a nível industrial são o óxido de etileno e o óxido de propileno, que são produzidos a uma escala de 15 milhões e 3 milhões de toneladas respectivamente.[1]
A epoxidação do etileno envolve a sua reacção catalítica de acordo com a seguinte estequiometria:
- 7 H2C=CH2 + 6 O2 → 6 C2H4O + 2 CO2 + 2 H2O
A reação direta do oxigénio com os alcenos é apenas útil para este epóxi. Outros alcenos não reagem de maneira útil, mesmo o propileno.
Peroxidação Olefínica
[editar | editar código-fonte]A maioria dos epóxis são gerados pelo tratamento dos alcenos com peróxidos contendo reagentes que doam um único átomo de oxigénio. Os peróxidos reagentes típicos incluem a água oxigenada, ácidos peroxicarboxilicos e hidroperóxidos alquílicos. Em aplicações especializadas, outros peróxidos com grupos reagentes são empregues, tal como o dimetildioxirano.
Neste tipo de abordagem, a aplicação em maior escala é a produção de Óxido de propileno usando tanto o hidroperóxido de t-butil ou hidroperóxido de etilbenzeno.[2]
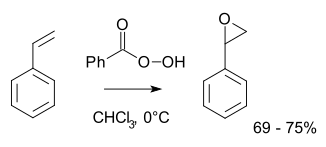
Normalmente, para operações laboratoriais, a reacção de Prilezhaev é empregue.[3][4] Esta abordagem envolve a oxidação do Alceno com um peroxiácido tal como o ácido 3-cloroperbenzoico. Ilustrativo é a epoxidação de estireno com o Ácido perbenzoico para a obtenção de óxido de estireno.[5]
A reacção procede via, como é comummente chamado, "mecanismo de borboleta".[6] O peróxido é visto como um electrófilo e o alceno como um nucleófilo. A reacção é considerada concertada (os números mostrados abaixo são simplificações).
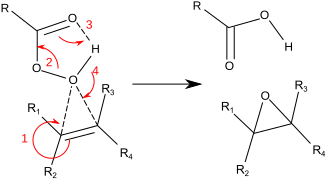
Os hidroperóxidos são também usados em epoxidações catalíticas enantiosselectivas tais como a epoxidação de Sharpless e a epoxidação de Jacobsen. Nestes casos, o oxigénio é entregue a partir de um óxido metálico ou peróxido. Conjuntamente com a epoxidação Shi, estas reacções são úteis para a síntese enantiosselectiva de epóxidos quirais. Reagentes como a oxiziridina também podem ser usados para gerar epóxis a partir de alcenos.
Substituição intramolecular SN2
[editar | editar código-fonte]Este método é uma variante da síntese de Wiliamson. Neste caso, um ião alcóxilo move um átomo de cloro dentro da mesma molécula. Os compostos percursores são chamados de halodrinas. Por exemplo, com 2-cloropropanol:[7]

Cerca de metade da produção mundial de óxido de propileno é proveniente desta abordagem.[2] Uma formação de epóxi intramolecular é um dos passos-chave na reacção de Darzens.
Na reacção de Johnson-Corey-Chaykovsky os epóxis são gerados a partir de grupos carbonilo e sulfónio. Nesta reacção, o sulfónio é o grupo que abandona em vez do cloro.
Os epóxidos são líquidos, incolores, solúveis em álcool, éter e benzeno.
Referências
- ↑ Rebsdat, Siegfried; Dieter Mayer (2001). Ullmann's Encyclopedia of Industrial Chemistry. Ethylene Oxide (em inglês) 1 ed. Nova Iorque: Wiley-VCH
- ↑ a b Kahlich, Dietmar; Uwe Wiechern et al (2011). Ullmann's Encyclopedia of Industrial Chemistry (em inglês). [S.l.]: Wiley-VCH
- ↑ March, Jerry (1985). Advanced Organic Chemistry. Reactions, Mechanisms and Structure (em inglês). 1 3ª ed. [S.l.]: John Wiley & Sons. 1512 páginas. ISBN 0471854727
- ↑ Prileschajew, Nikolaus (1909). «Oxydation ungesättigter Verbindungen mittels organischer Superoxyde». Berichte der deutschen chemischen Gesellschaft. 42 (4): 4811-4815
- ↑ Hibbert, Harold; Pauline Burt (1941). Organic Syntheses. Styrene oxide (em inglês) 1ª ed. Londres: [s.n.] p. 494
- ↑ Bartlett Rec. Chem. Prog 1950, 11 47.
- ↑ Koppenhoefer, B.; Schurig, V. (1993). «(R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane». Organic Syntheses. Organic Syntheses (em inglês). 8. 434 páginas