Acid glicolic
| Acid glicolic | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 79-14-1 |
| ChEMBL | CHEMBL252557 |
| PubChem CID | 757 |
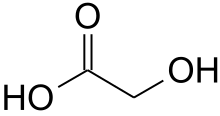
| Formulă chimică | C₂H₄O₃[1] |
| Masă molară | 76,016 u.a.m.[1] |
| Punct de topire | 77 °C[2] |
| Punct de fierbere | 100 °C[3] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
| Acid glicolic | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 79-14-1[4][5] |
| PubChem | 757[1] |
| DrugBank | DB03085 |
| ChemSpider | 737[6] |
| UNII | 0WT12SX38S[5] |
| KEGG | C00160 |
| ChEMBL | CHEMBL252557[7] |
| SMILES | C(C(=O)O)O[1] |
| InChI | InChI=InChI=1S/C2H4O3/c3-1-2(4)5/h3H,1H2,(H,4,5)[1] |
| Date chimice | |
| Formulă | C₂H₄O₃[1] |
| Masă molară | 76,016 u.a.m.[1] |
| Date fizice | |
| Punct de topire | 77 °C[2] |
| Punct de fierbere | 100 °C[3] |
| Modifică date / text | |
Acidul glicolic (denumit și acid hidroxiacetic) este cel mai simplu α-hidroxiacid. Este un compus incolor, inodor, cristalin și higroscopic, foarte solubil în apă. Sărurile și esterii săi sunt denumiți glicolați.
Acid glicolic (acid hidroacetic sau acid hidroxiacetic); formula chimică C2H4O3 (scrisă și ca HOCH2CO2H), care este cel mai mic acid α-hidroxi (AHA). Acest solid cristalin incolor, inodor și higroscopic este foarte solubil în apă. Este utilizat în diverse produse de îngrijire a pielii. Acidul glicolic se găsește în unele plante de zahăr. Un glicolat este o sare sau un ester al acidului glicolic.
Producere
Există mai multe metode de a obține acidul glicolic. Principala metodă utilizată este o reacție de carbonilare catalitică a formaldehidei, și se face cu gaz de sinteză:[8]
Poate rezulta și din oxidarea la grupa metil a acidului acetic.
Proprietăți
Acidul glicolic este un acid mai tare decât acidul acetic, datorită grupei hidroxil care este o grupă atrăgătoare de electroni. Grupa carboxilică formează complecși coordinativi cu ioni metalici, exemple fiind ionii de Pb2+ și de Cu2+.[9]
Istorie
Numele de "acid glicolic" a fost dat în 1848 de chimistul francez Auguste Laurent (1807-1853). El propunea ca aminoacidul glicină - care ulterior s-a numit glicocol - să poată fi aminoacidul unui acid ipotetic, pe care l-a numit „acid glicolic” (acid glicolic).
Acidul glicolic a fost preparat pentru prima dată în 1851 de chimistul german Adolph Strecker (1822-1871) și chimistul rus Nikolai Nikolaevich Sokolov (1826-1877). L-au produs prin tratarea acidului hipuric cu acid azotic și dioxid de azot pentru a forma esteri ai acidului benzoic și acid glicolic (C6H5C (= O) OCH2COOH), pe care l-au numit „acid benzoglicolic” (Benzoglykolsäure), (de asemenea, acid benzoil glicolic). Au fiert esterul câteva zile cu acid sulfuric diluat, obținând astfel acid benzoic și acid glicolic (Glykolsäure).
Note
- ^ a b c d e f g h i j k l m n o p q „Acid glicolic”, glycolic acid (în engleză), PubChem, accesat în
- ^ a b c Jean-Claude Bradley Open Melting Point Dataset
- ^ a b c Basic laboratory and industrial chemicals: A CRC quick reference handbook[*] Verificați valoarea
|titlelink=(ajutor) - ^ a b CAS Common Chemistry, accesat în
- ^ a b c d glycolic acid (în engleză), Global Substance Registration System, accesat în
- ^ a b Glycolic acid (în engleză), ChemSpider, accesat în
- ^ a b GLYCOLIC ACID (în engleză), ChEMBL, accesat în
- ^ D.J. Loder, U.S. Patent 2.152.852 (1939).
- ^ Sigel, Astrid; Operschall, Bert P.; Sigel, Helmut (). „Chapter 11. Complex Formation of Lead(II) with Nucleotides and Their Constituents”. În Astrid, S.; Helmut, S.; Sigel, R. K. O. Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. 17. de Gruyter. pp. 319–402. doi:10.1515/9783110434330-011.
Vezi și
| ||||||||
| |||||||||||||||||||||||