C4-фотосинтез
C4-фотосинтез, или цикл Хэтча — Слэка, — путь связывания углерода, характерный для высших растений, первым продуктом которого является четырёхуглеродная щавелевоуксусная кислота, а не трёхуглеродная 3-фосфоглицериновая кислота, как у большинства растений с обычным C3-фотосинтезом.
По своей сути C4-фотосинтез представляет собой модификацию обычного C3-фотосинтеза и появился в процессе эволюции значительно позже последнего. В цикле Хэтча — Слэка растения осуществляют первичную фиксацию углерода в клетках мезофилла через карбоксилирование фосфоенолпирувата (ФЕП) при участии фермента фосфоенолпируваткарбоксилазы (ФЕП-карбоксилаза). Образовавшийся в результате реакции оксалоацетат превращается в малат или аспартат и в таком виде транспортируется в клетки обкладки проводящего пучка, где в результате декарбоксилирования высвобождается CO2, поступающий в восстановительный пентозофосфатный цикл[1]. В цикле Кальвина у C4-растений, как и у C3-растений, CO2 превращается в трёхатомный сахар, который идёт на синтез сахарозы. Транспорт CO2 из клеток мезофилла в клетки обкладки в виде промежуточных продуктов фиксации позволяет значительно повысить его концентрацию в месте локализации Рубиско и таким образом значительно увеличить её эффективность, избежав побочной реакции с кислородом и, как следствие, полностью избавиться от фотодыхания.
Благодаря более эффективному способу фиксации CO2 отпадает необходимость всё время держать устьица открытыми для обеспечения активного газообмена, а значит снижаются потери воды в ходе транспирации. По этой причине C4-растения способны расти в более засушливых местообитаниях, при высоких температурах, в условиях засоления и недостатка CO2. Тем не менее, дополнительные шаги по фиксации углерода в C4-пути требуют дополнительных затрат энергии в форме АТФ. Если принять, что в цикле Кальвина у C4-растений, так же как и у C3-растений, для фиксации одной молекулы CO2 используются 3 молекулы АТФ и 2 молекулы НАДФН, то для регенерации акцептора углерода в цикле Хэтча — Слэка, то есть превращения пирувата в ФЕП, требуются дополнительно 2 молекулы АТФ. В итоге на одну молекулу CO2 в C4-пути расходуется 5 молекул АТФ и 2 молекулы НАДФН[2]. По этой причине C4-растениям для оптимального роста требуется более высокий уровень инсоляции.
История открытия
Первое упоминание о том, что у сахарного тростника первым продуктом фотосинтеза может быть дикарбоновая четырёхуглеродная кислота, появилось в 1954 году в виде короткой заметки без ссылки и было опубликовано в ежегодном отчёте экспериментальной станции гавайской ассоциации сахарных плантаторов. В более подробном виде эта работа появилась в виде короткого сообщения за авторством Х. П. Корчака, К. Э. Хартта и Г. O. Бурра. Полноценная статья этой группы исследователей была опубликована только в 1965 году[3]. Такая большая задержка объясняется несоответствием полученных результатов с данными, полученными в лаборатории Мелвина Кальвина, с которой у гавайской группы в то время был тесный контакт[4].
Схожие результаты примерно в то же время получили и советские учёные. В работах Л. А. Незговоровой (1956—1957 гг.), было установлено, что при коротких экспозициях листьев кукурузы на свету 14С из 14СО2 обнаруживается в аспарагиновой кислоте[5]. Примерно в то же время, в 1960 году, русский учёный Ю. С. Карпилов опубликовал данные, демонстрирующие, что при радиоактивном мечении у кукурузы первыми образуются яблочная и аспарагиновая кислоты[6].В 1963 году Ю. С. Карпилов совместно со своим коллегой И. А. Тарчевским опубликовал вторую статью, в которой рассматривалось влияние процедуры убийства листьев на радиоактивное мечение продуктов фотосинтеза. Свою следующую статью на эту тему Карпилов опубликовал только в 1969 году. Само собой разумеется, ни советские, ни гавайские учёные не знали о достижениях друг друга вплоть до 1969 года[4].
Работавшие в то время в лаборатории австралийской компании CSR Limited[англ.] в городе Брисбен учёные Маршал Дэвидсон Хэтч и Чарльз Роджер Слэк знали о результатах гавайской группы начиная с 1960. Поэтому в 1965, когда была опубликована полноценная статья, они решили перепроверить эти данные. Повторив результаты гавайской группы по радиоактивному мечению продуктов фотосинтеза сахарного тростника, они определили оксалоацетат как первый акцептор углерода, использовав особую технику умерщвления[4]. На основании своих данных они составили простую рабочую модель и в 1966 году опубликовали статью, в которой впервые описали этот биохимический путь как новый тип фотосинтеза, принципиально отличающийся от цикла Кальвина[7][4].
В течение следующих четырёх лет Хэтч и Слэк проделали большую работу по расшифровке C4-пути: они постулировали и подтвердили роль ФЕП-карбоксилазы в первичной фиксации CO2, ими была открыта растительная пируватфосфатдикиназа, несколько ранее обнаруженная у бактерий, а также ранее неизвестная НАДФ-зависимая малатдегидрогеназа. Кроме того они исследовали локализацию этих, а также многих других ферментов в клетках мезофилла и обкладки пучка. В то время предполагалось, что четырёхуглеродные дикарбоновые кислоты должны передавать один атом углерода к некоему предшественнику с образованием триозофосфата в реакции перекарбоксилирования. Однако позже, когда было обнаружено, что в клетках обкладки в больших количествах локализуется декарбоксилирующий НАДФ-малик-энзим, стало ясно, что СO2 попадет в цикл Кальвина в результате повторной фиксации, и эта гипотеза отпала. В 1970 году Хэтч и Слэк на международном собрании в Канберре представили детальную схему С4-фотосинтеза НАДФ-малатдегидрогеназного типа, где собравшимися было высказано предположение, что этот путь служит для концентрирования CO2 в клетках обкладки проводящего пучка, которое вскоре подтвердилось. Значение этого нагнетающего механизма для подавления оксигеназной активности Рубиско и фотодыхания стало понятно только в течение последующих нескольких лет[4]
Изначально Хэтч и Слэк назвали описанный ими тип фотосинтеза С4-фотосинтетический путь дикарбоновых кислот[4], название, которое позже было сокращено до С4-фотосинтез. Впоследствии в литературе этот процесс получил также название цикл, или путь Хэтча — Слэка. В отечественной литературе иногда встречается обозначение путь Хэтча — Слэка — Карпилова, подчёркивающее вклад советского исследователя.
Анатомия листа

Для C4-растений характерна особая структура листа, так называемая кранц-анатомия (нем. Kranz — корона, венец). Впервые такой тип строения листа был описан в 1884 году немецким ботаником Готлибом Габерландтом[8]. Проводящие пучки у таких растений окружены двумя слоями зелёных клеток ассимиляционной паренхимы. Внешний слой образуют клетки мезофилла, не дифференцированного на губчатую и палисадную паренхиму, а внутренний — клетки обкладки сосудистого пучка. Клетки обкладки связаны с клетками мезофилла множеством плазмодесм, благодаря чему между ними возможен активный обмен метаболитами. Особенностью строения листа C4-растений является наличие не более 2-3 слоёв клеток мезофилла, что позволяет легко обмениваться продуктами фотосинтеза через плазмодесмы. Клетки мезофилла и клетки обкладки проводящего пучка отличаются структурно и функционально. Клетки мезофилла мелкие, расположены рыхло, хлоропласты в них всегда имеют граны и они редко содержат крахмал. В этих клетках и располагается ФЕП-карбоксилаза, которая присоединяет CO2 к фосфоенолпирувату с образованием оксалоацетата. Клетки обкладки более крупные, с утолщённой, часто суберинизированной, клеточной стенкой, плотно прилегают к сосудам листа, хлоропласты в них могут не иметь гран и часто содержат зёрна крахмала. Здесь локализуется фермент Рубиско и протекает обычный цикл Кальвина[9].
Для некоторых C4-растений также характерен диморфизм хлоропластов, когда у хлоропластов клеток мезофилла есть многочисленные граны, а в клетках обкладки граны рудиментарны и практически полностью отсутствуют[10]. Тем не менее такой диморфизм не является необходимым для C4-фотосинтеза и встречается только среди растений с определённым его биохимическим типом[11].
Не у всех видов C4-растений есть субериновый слой, но все они стремятся предотвратить диффузию CO2 из клеток обкладки, поэтому положение хлоропластов в этих клетках становится особенно важным. У видов с субериновым слоем хлоропласты расположены центробежно, то есть на максимальном удалении от проводящего пучка и ближе к мезофиллу. У видов без суберинового слоя хлоропласты расположены центростремительно, впритык к клеточной стенке, максимально приближенной к проводящему пучку и в удалении от мезофилла. Такое распределение хлоропластов удлиняет путь диффузии CO2 и снижает утечку в клетки мезофилла[12].
Биохимия

У C3-растений темновые реакции фотосинтеза начинаются с фиксации CO2 ферментом Рубиско на акцепторе рибулозо-1,5-бисфосфате с образованием двух молекул 3-фосфоглицерата. Однако из-за двойной (карбоксилазной и оксигеназной) активности Рубиско, часть субстрата для фиксации CO2 взаимодействует с кислородом и окисляется, что приводит к потере субстрата и энергии, а также влечёт за собой дополнительные затраты по утилизации образовавшегося двухуглеродного соединения, 2-фосфогликолата. Сумма этих процессов носит название фотодыхание и вносит существенный вклад в снижение общей эффективности фотосинтеза.
Чтобы преодолеть ограничения, связанные с побочной реакцией Рубиско в условиях низкого содержания в современной атмосфере CO2 и высокого O2, C4-растения выработали эффективный механизм концентрирования CO2 в месте локализации Рубиско, создавая благоприятные условия для работы этого фермента. Вместо прямой фиксации Рубиско в цикле Кальвина, CO2 ассимилируется в клетках мезофилла в виде четырёхуглеродной органической кислоты, которая затем транспортируется в клетки обкладки сосудистых пучков, где декарбоксилируется, высвобождая CO2. Анатомической предпосылкой нагнетания CO2 является большее число клеток мезофилла (примерно 5—7 на одну клетку обкладки). Таким образом, CO2, предварительно зафиксированный в пяти клетках, попадает в одну[13]. В клетках обкладки CO2 поступает в обычный цикл Кальвина, где вторично фиксируется Рубиско и используется для синтеза углеводов. Благодаря постоянному градиенту метаболитов, а также непроницаемой для CO2 стенке клеток обкладки, концентрация CO2 в сайте карбоксилирования Рубиско даже при закрытых устьицах возрастает в 14 раз по сравнению с равновесной концентрацией CO2 в воде (с 5 мкмоль/л до 70 мкмоль/л соответственно)[14]. При таких высоких концентрациях CO2 в сайте карбоксилирования оксигеназная реакция в значительной степени подавлена, возрастает эффективность фотосинтеза, снижаются потери энергии на фотодыхание.
Первичную фиксацию CO2 у C4-растений осуществляет фермент фосфоенолпируваткарбоксилаза или ФЕП-карбоксилаза, расположенная в клетках мезофилла. В отличие от Рубиско, она фиксирует углекислый газ в форме гидрокарбонат-иона HCO3−, а не CO2. Поскольку в качестве субстрата используется заряженная молекула, то полностью исключается побочная реакция с незаряженной молекулой наподобие O2, которая к тому же отличается от гидрокарбоната по пространственному строению. Эффективность механизма предварительной фиксации CO2 при помощи ФЕП-карбоксилазы заключается не в высоком сродстве фермента к субстрату (Km(HCO3−) = 0,2—0,4 ммоль/л для ФЕП-карбоксилазы[13] против Km(CO2) = 10—15 мкмоль/л для Рубиско[15]), а в том, что в цитозоле при нормальной температуре и рН 8 отношение HCO3−:CO2 составляет приблизительно 50:1. Таким образом, ФЕП-карбоксилаза, в отличие от Рубиско, может присоединять доминирующую в этой равновесной реакции форму углекислоты и результативно проводить фиксацию CO2, даже если при полузакрытых устьицах концентрация растворенного в воде CO2 упадёт ниже уровня, приемлемого для Рубиско[16]. Образование HCO3− из CO2 происходит с участием цинк-содержащего фермента карбоангидразы, которая также локализована в цитозоле клеток мезофилла и ускоряет установление равновесия между двумя формами углекислоты:
ФЕП-карбоксилаза катализирует необратимую конденсацию молекул ФЕП и HCO3− с образованием оксалоацетата. ФЕП-карбоксилаза имеет очень высокое сродство к ФЕП. Оксалоацетат преобразуется в малат или же в аспартат и в таком виде транспортируется в клетки обкладки, где снова становится малатом и подвергается окислительному декарбоксилированию:
|
В результате окислительного декарбоксилирования из малата образуется CO2 и пируват, который в той или иной форме возвращается в клетки мезофилла, где снова превращается в ФЕП при помощи расположенного в хлоропластах фермента пируватортофосфатдикиназы[англ.]. Катализируемая ферментом реакция довольно необычна, название «дикиназа» обозначает фермент, который катализирует двукратное фосфорилирование. На первой, обратимой стадии реакции один фосфатный остаток передаётся с АТФ на неорганический фосфат с образованием пирофосфата, а второй (Фβ) присоединяется к пирувату. Локализованная в строме хлоропластов пирофосфатаза[англ.] мгновенно гидролизует образовавшийся пирофосфат, что делает реакцию необратимой[17]. Таким образом происходит регенерация акцептора углекислого газа и замыкание цикла.
|
Эффективный механизм углекислотного концентрирования позволяет C4-растениям создать такой диффузный ток, чтобы обеспечить достаточное поступление углекислого газа даже при увеличенном сопротивлении устьиц. Именно этот эффект позволяет тратить почти в два раза меньше воды на фиксацию одной молекулы CO2, чем у C3-растений, ведь с уменьшением ширины устьичной щели пропорционально падают и потери воды[14].
Три типа C4-фотосинтеза
В соответствии с типом C4-кислоты, которая служит переносчиком углекислого газа в клетки обкладки (малат или аспартат), C3-продуктом, который возвращается в клетки мезофилла для регенерации (пируват или аланин), а также с характером декарбоксилирующих реакций в клетках обкладки выделяют три варианта С4-пути фотосинтеза[18]:
- НАДФ+-малатдегидрогеназный тип: Малат подвергается окислительному декарбоксилированию в хлоропластах под действием НАДФ-зависимой декарбоксилирующей малатдегидрогеназы (НАДФ-зависимый малик-энзим) с образованием молекулы НАДФH и CO2.
- НАД+-малатдегидрогеназный тип: Малат декарбоксилируется в митохондриях при помощи НАД-зависимой декарбоксилирующей малатдегидрогеназы (НАД-зависимый малик-энзим) с образованием одной молекулы НАДН. Выделившийся диоксид углерода диффундирует в хлоропласты.
- ФЕП-карбоксикиназный тип: Малат декарбоксилируется в митохондриях по НАД-малатдегидрогеназному типу, но также имеет место и прямое декарбоксилирование оксалоацетата в цитоплазме ФЕП-карбоксикиназой с затратой одной молекулы АТФ и образованием ФЕП.
ФЕП-карбоксикиназа (ФЕПКК) была обнаружена у такого типичного НАДФ-МДГ растения, как кукуруза, что позволяет ему транспортировать углекислоту в форме аспартата (около 25 %); многие двудольные C4-растения тоже содержат ФЕПКК в дополнение к основному декарбоксилирующему ферменту. Сосуществование разных типов C4-фотосинтеза, например, НАДФ-МДГ и ФЕПКК или НАД-МДГ и ФЕПКК, обеспечивает растению дополнительную гибкость и возможность транспортировать иные типы C4-кислот и продуктов, которые возвращаются в клетки мезофилла для регенерации. Более того, некоторые растения без ФЕПКК-активности всё же способны транспортировать несколько метаболитов, например аспартат и малат, как это происходит у сорго зернового. Каждый из смешанных типов С4-фотосинтеза, также как и «чистые» НАДФ- и НАД-малатдекарбоксилазные пути имеют свои определённые экологические преимущества. В этом смысле следует считать разделение на три независимых биохимических типа относительно условным[19].
ФЕП-карбоксикиназный тип никогда не встречается в чистом виде, и даже у растений, традиционно относимых к этому типу, ФЕП-карбоксикиназа обеспечивает хоть и бо́льшую, но никогда всю декарбоксилирующую активность. Помимо прочего, ФЕП-карбоксикиназа широко используется как вспомогательная декарбоксилаза растениями с НАДФ- и НАД-МДГ типами. По этой причине было предложено подразделять С4-фотосинтез только на НАДФ- и НАД-малатдегидрогеназные типы, которые чётко отличаются по декарбоксилирующему ферменту и плану строения, а ФЕП-карбоксилазный тип рассматривать как вспомогательный, анаплеротический путь[англ.], который в разной мере используется разными растениями[19].
НАДФ-малатдегидрогеназный тип (НАДФ-МДГ)

НАДФ-малатдегидрогеназный тип (НАДФ-МДГ)[13] или НАДФ-маликэнзимный тип (НАДФ-МЭ)[20] исторически был первым исследованным биохимическим типом C4-фотосинтеза. По этому пути осуществляют фотосинтез такие важные сельскохозяйственные культуры, как кукуруза, сорго, росичка и сахарный тростник[21]. В качестве транспортных продуктов используются малат и пируват.
Оксалоацетат, который образуется в результате карбоксилирования ФЕП, с помощью специфичного переносчика транспортируется в хлоропласты, где восстанавливается НАДФ-малатдегидрогеназой до малата. Образовавшийся малат выносится в цитозоль и диффундирует из клеток мезофилла в клетки обкладки через плазмодесмы. Малик-энзим, который локализован в хлоропластах клеток обкладки, катализирует преобразование малата в пируват с выделением СO2, который фиксируется Рубиско. Образовавшийся пируват с участием специфичного переносчика экспортируется из хлоропластов клеток обкладки и диффундирует через плазмодесмы в клетки мезофилла, где он с помощью другого переносчика входит в хлоропласты, где фермент пируватфосфатдикиназа снова превращает его в ФЕП[13].
Поскольку хлоропласты клеток обкладки, в отличие от хлоропластов клеток мезофилла, не содержат карбоангидразы, диффузия СO2 в строме клеток обкладки происходит медленнее, чем в клетках мезофилла. Субериновый слой между клетками обкладки и мезофилла у некоторых растений, вероятно, также затрудняет утечку СO2 через клеточные стенки, так что остается только возможность утечки через плазмодесмы. Долю СO2, который был сконцентрирован в клетках обкладки, но вследствие утечки диффундировал обратно в клетки мезофилла, оценивают как 10—30 % для разных видов[22].
Для растений, обладающих этим типом C4-фотосинтеза, характерно наличие диморфизма хлоропластов. Хлоропласты клеток мезофилла имеют много гран, в то время как хлоропласты клеток обкладки содержат преимущественно стромальные ламеллы и малое количество гранальных стопок с низкой активностью фотосистемы II, что позволяет уменьшить содержание кислорода в сайте активности Рубиско. Существует градация в количестве гран хлоропластов клеток обкладки, начиная с рудиментарных гран у кукурузы и росички и вплоть до полного их отсутствия у сорго и сахарного тростника[23]. Агранальные хлоропласты клеток обкладки осуществляют циклическое фосфорилирование при участии фотосистемы I и синтезируют только АТФ. Все восстановительные эквиваленты, необходимые для цикла Кальвина, обеспечивают клетки мезофилла за счёт нециклического электронного транспорта. Окисление в клетках обкладки малата обеспечивает не более трети необходимых для работы цикла Кальвина НАДФН. Оставшаяся часть необходимого НАДФН вместе с АТФ поставляется из хлоропластов клеток мезофилла в хлоропласты клеток обкладки с помощью триозофосфат-3-фосфоглицератного челночного механизма, через триозофосфатный переносчик внутренней мембраны соответствующих хлоропластов[24].
НАД-малатдегидрогеназный тип (НАД-МДГ)

НАД-малатдегидрогеназный тип (НАД-МДГ)[13] или НАД-маликэнзимный тип (НАД-МЭ)[20] обнаружен у большинства видов, включая просо, амарант, портулак[18], иван-чай и марь[25]. Хлоропласты как клеток мезофилла, так и клеток обкладки имеют граны и активную фотосистему II[26]. Клетки обкладки содержат множество крупных митохондрий с хорошо развитыми кристами[27]. В качестве транспортных продуктов используются аспартат и аланин.
В этом случае оксалоацетат, который образуется в реакции ФЕП-карбоксилазы, превращается в аспартат путём переаминирования, которое катализирует глутамат-аспартатаминотрансфераза. Поскольку концентрация глутамата в клетке велика, он удобен для поддержания диффузионного тока между клетками мезофилла и обкладки. В результате трансаминирования концентрация аспартата становится в 5 раз выше концентрации оксалоацетата, что создаёт сильный диффузионный ток. После диффузии в клетки обкладки аспартат транспортируется в митохондрии. Митохондриальная изоферментная форма глутамат-аспартатаминотрансферазы катализирует превращение аспартата в оксалоацетат, который затем восстанавливается НАД-малатдегидрогеназой до малата. Малат декарбоксилируется НАД-малик-энзимом с образованием пирувата, а НАД+, образовавшийся в реакции восстановления оксалоацетата, вновь восстанавливается до НАДН. Образовавшийся в ходе реакции СO2 диффундирует в хлоропласты, где ассимилируется с участием Рубиско. Пируват выходит из митохондрий и в цитозоле превращается в аланин с участием аланин-глутаматаминотрансферазы. Поскольку эта реакция равновесная, а концентрация аланина гораздо выше, чем пирувата, возникает интенсивный диффузионный ток аланина в клетки мезофилла. В клетках мезофилла аланин превращается в пируват с участием всё той же аминотрансферазы, которая упоминалась выше. Пируват транспортируется в хлоропласты, где превращается в ФЕП с участием пируватфосфатдикиназы так же, как в случае с НАДФ-МДГ типом[26].
ФЕП-карбоксикиназный тип (ФЕПКК)

ФЕП-карбоксикиназный тип (ФЕПКК или ФЕП-КК)[13] был обнаружен у нескольких быстрорастущих тропических злаков, которые используются в качестве кормовых культур. Этот путь фотосинтеза используют часть представителей рода просо (гвинейская трава[англ.]), хлорис гайанская[англ.][21] и баклажан[25]. Хлоропласты как клеток мезофилла, так и клеток обкладки имеют граны и активную фотосистему II[26]. В качестве транспортных продуктов используются аспартат, аланин, малат и фосфоенолпируват.
Как и в С4-метаболизме НАД-МДГ типа, оксалоацетат превращается в аспартат в клетках мезофилла. Аспартат диффундирует в клетки обкладки, где с участием аминотрансферазы, локализованной в цитозоле, происходит регенерация оксалоацетата. В цитозоле под действием фермента ФЕП-карбоксикиназы оксалоацетат превращается в ФЕП с затратой АТФ. Выделившийся в реакции СO2 диффундирует в хлоропласты, а ФЕП диффундирует обратно в клетки мезофилла. У растений этого типа затраты АТФ на накачивание СO2 в клетки обкладки связаны преимущественно с потреблением АТФ ФЕП-карбоксикиназой. Митохондрии обеспечивают эту реакцию необходимым количеством АТФ, окисляя малат при участии НАД-малик-энзима. Источником малата, как и в случае НАДФ-малатдегидрогеназного типа, являются клетки мезофилла. Таким образом, в метаболизме С4-ФЕП-карбоксикиназного типа лишь небольшая часть СO2 высвобождается в митохондриях, а бо́льшая часть — в цитозоле[28].
Регуляция
C4-фотосинтез регулируется по трём основным ферментам, каждый из которых активируется светом, так что С4-путь активен исключительно в светлое время суток.
ФЕП-карбоксилаза регулируется двумя путями: через фосфорилирование и аллостерически. Основными аллостерическими ингибиторами ФЕП-карбоксилазы являются карбоновые кислоты, такие как малат и аспартат[29][30]. Поскольку малат образуется на следующем шаге САМ- и С4-циклов, сразу после того как ФЕП-карбоксилаза катализирует конденсацию СО2 и ФЕП в оксалоацетат, то образуется обратная связь. И аспартат, и оксалоацетат легко превращаются друг в друга по механизму трансаминирования; таким образом, высокие концентрации аспартата путём обратной связи ингибируют ФЕП-карбоксилазу.
Основные аллостерические активаторы ФЕП-карбоксилазы у растений — это триозофосфаты[31] и фруктозо-1,6-бисфосфат[32]. Обе молекулы являются индикаторами активного гликолиза и сигнализируют о необходимости производства оксалоацетата, чтобы усилить поток вещества через цикл трикарбоновых кислот. Кроме того, увеличение гликолиза означает усиленное снабжение ФЕП и, следовательно, больше акцептора для фиксации СО2 и транспорта его в цикл Кальвина.
Когда лист находится в темноте, активность ФЕП-карбоксилазы низка. В этом случае сродство фермента к субстрату, ФЕП, очень низкое; процесс также ингибируется низкими концентрациями малата. Поэтому в тёмное время суток фермент в листе практически неактивен. При освещении листа неизвестным путём активируется киназа ФЕП-карбоксилазы, которая фосфорилирует гидроксильную группу серинового остатка в белке ФЕП-карбоксилазы. Киназа ФЕП-карбоксилазы быстро распадается, поэтому количество фермента в клетке определяется интенсивностью транскрипции гена. ФЕП-карбоксилаза может вновь быть инактивирована в случае удаления фосфатной группы специфической фосфатазой. Активированный (фосфорилированный) фермент также ингибируется малатом, но в этом случае для достижения эффекта необходимы более высокие концентрации малата. Как киназа, так и фосфатаза регулируются на уровне транскрипции. Существует также мнение, что малат обеспечивает обратную связь в этом процессе, снижая уровень экспрессии киназы и повышая экспрессию фосфатазы[30].

Пируватфосфатдикиназа (ПФДК) также является светозависимым ферментом. Она инактивируется в темноте за счёт фосфорилирования по остатку треонина. Эту реакцию осуществляет необычный бифункциoнальный ПФДК-регулирующий протеин (ПФДК-РП или ПДРП). Он одновременно обладает киназной и фосфатазной активностью. Фосфорилирование довольно необычно, поскольку в качестве донора фосфатной группы используется предпочтительно АДФ, а не АТФ. Необычна и реакция дефосфорилирования: вместо молекулы воды ПФРП переносит отщепляемую фосфатную группу на свободный неорганический фосфат (Фн) с образованием пирофосфата (ФФн). Активность ПДРП зависит от уровня АДФ в строме хлоропластов. АДФ является субстратом для киназной активности и одновременно сильным конкурентным ингибитором фосфатазной. В темноте уровень АДФ значительно повышается, в результате чего подавляется фосфатазная активность. На свету, за счёт фотофосфорилирования, концентрация АДФ резко сокращается, не остаётся субстрата для киназной реакции, а фосфатазная перестаёт подавляться. В результате ПДРП отщепляет фосфат от пируватфосфатдикиназы и активирует её[33].
НАДФ-малатдепадрогеназа активируется светом за счёт работы ферредоксин-тиоредоксиновой системы. В ходе световых реакций фотосинтеза энергия света питает транспорт электронов от воды к ферредоксину. Фермент ферредоксин-тиоредоксинредуктаза использует восстановленный ферредоксин для восстановления дисульфидной связи тиоредоксина из дисульфида до дитиола. Восстановленный тиоредоксин восстанавливает цистеин-цистеиновую дисульфидную связь в НАДФ-малатдепадрогеназе, что переводит фермент в активную форму[28].
Дискриминация изотопов
Удобный метод идентификации С4-растений базируется на определении соотношения изотопов углерода 13С/12С. Метод основан на том, что растения во время фотосинтеза поглощают природные изотопы углерода в разных количествах (в атмосферном CO2 содержится 98,89 % 12С и 1,11 % 13С). В целом растения отдают предпочтение 12CO2, в меньшей степени поглощают 13CO2 и в ещё меньшей степени — 14CO2. Фракционирование 13CO2 более выражено при работе Рубиско, поскольку катализируемая этим ферментом реакция протекает медленнее, и более лёгкий изотоп 12CO2 фиксируется ферментом куда охотнее, чем медленно диффундирующий 13CO2. Более быстрая ФЕП-карбоксидаза не делает различия между изотопами, а поскольку у С4-растений Рубиско реализует практически весь предварительно зафиксированный ФЕП-карбоксилазой CO2, то процент 13С в С4-растении соответствует продукту ФЕП-карбоксилазной реакции, в то время как в С3-растении определяется по соотношению изотопов, характерному для Рубиско. Соответственно С4-растения содержат относительно более высокий процент 13С. Углеводы, выделенные из С4-растений, тяжелее, чем сахара из С3-растений[21]. Соотношение 13С/12С определяется масс-спектрометрическими методами и выражается значением δ13С, которое представляет собой отклонение изотопного состава исследуемого образца (13С/12С)обр от изотопного состава стандарта (13С/12С)ст. Стандартом (PDB или Чикагским стандартом) служит соотношение изотопов в кальците окаменелости Belemnitella americana мелового периода; δ13С в исследуемом образце принято выражать в промилле следующим образом[34]:
Чем более отрицательным получается значение δ13С, тем меньше содержание изотопа 13С. У С4-растений значение δ13С составляет около −14 ‰, у С3-растений — около −28 ‰. Поскольку сахарный тростник является С4-растением, а сахарная свёкла — С3-растением, по содержанию изотопа 13С можно масс-спектрометрически определить происхождение сахарозы. Таким способом можно, например, отличить настоящий ром (приготовленный из сахарного тростника) от купажированного (с добавкой сахара, приготовленного из свёклы)[21].
Особые формы C4-фотосинтеза
C4-фотосинтез без кранц-анатомии

Хотя большинство C4-растений обладает кранц-анатомией, есть несколько видов, осуществляющих C4-цикл без разделения на клетки обкладки и мезофилла. Эти четыре растения относятся к подсемейству маревые: Suaeda aralocaspica[англ.], Bienertia cycloptera, Bienertia sinuspersici и Bienertia kavirense. Они произрастают в пустынных, засолённых районах Среднего Востока: B. sinuspersici в разных странах Персидского залива, B. cycloptera в Турции, Афганистане и Иране, B. kavirense в иранской соляной пустыне (Деште-Кевир), а S. aralocaspica возле соляных заводов в Центральной Азии. Для них характерен уникальный С4-механизм нагнетания CO2 в рамках одной клетки[35][36][37][38]. Все вышеперечисленные растения относятся к НАД-МДГ биохимическому типу[39].
Хотя цитологическое строение в двух родах различается, основной принцип в обоих случаях заключается в использовании больших вакуолей для разделения клетки на два отсека. У S. aralocaspica имеются очень длинные клетки палисадной паренхимы, разделённые на два отсека большой вакуолью, которая занимает почти всё пространство клетки. Паренхима располагается в один слой и более плотно упакована с внешней стороны листа, но более рыхло с внутренней. В ближнем к эпидерме листа (дистальном) регионе располагаются хлоропласты с низким содержанием гран и без Рубиско, здесь происходит синтез ФЕП из пирувата при помощи фермента пируватфосфатдикиназы. Во внутреннем (проксимальном) участке расположены обычные гранальные хлоропласты и митохондрии, здесь есть Рубиско и действует цикл Кальвина[39].
Представители рода Bienertia[англ.] имеют другое строение. Паренхима листа располагается в два-три слоя. Бо́льшая часть клетки заполнена вакуолями и разбита на тонкую цитозольную полоску на периферии и необычный центральный отсек с большим количеством хлоропластов в середине. Здесь наблюдается некий аналог кранц-анатомии, на периферии располагаются крупные хлоропласты с уменьшенным количеством гран и неполным набором ферментов цикла Кальвина, где происходит регенерация ФЕП, а в центре расположено скопление вдвое меньших хлоропластов с нормальными гранами и активной Рубиско, где протекает цикл Кальвина. Вместе с этими хлоропластами в центре расположены митохондрии и пероксисомы[39].
В обоих случаях за распределение двух типов хлоропластов по клетке отвечает актиновый и микротрубочковый цитоскелет. Также при одноклеточном С4-фотосинтезе не происходит обособления ФЕП-карбоксилазы, она равномерно располагается по всей клетке. В связи с этим возникает вопрос о возможном механизме её ингибирования в месте работы Рубиско, чтобы избежать повторной фиксации высвобожденного CO2[39].
В качестве другого примера C4-фотосинтеза без кранц-анатомии можно привести морскую зелёную макроводоросль Udotea flabellum[40] и одноклеточную диатомею Thalassiosira weissflogii[англ.][41].
Факультативный C4-фотосинтез

Hydrilla verticillata — пресноводное погружённое цветковое растение, которое в летнее время собирается в большие маты под поверхностью воды. В условиях высокой температуры, низкого содержания CO2 и высокого O2 растение переходит от C3- к C4-фотосинтезу. Поскольку у Hydrilla verticillata нет кранц-анатомии, весь процесс происходит внутри одной клетки. Фотосинтез идёт по НАДФ-МДГ биохимическому пути, в цитоплазме происходит индукция синтеза ФЕП-карбоксилазы, а также ряда других белков: малик-энзима, ПФДК и аминотрансфераз. Главный декарбоксилирующий фермент — НАДФ-малик-энзим располагается в хлоропластах, там же действует пируватфосфатдикиназа, регенерирующая ФЕП[42].
В качестве другого примера переключения между C3- и C4-метаболизмом можно привести безлистную осоку Элеохарис живородящий[англ.], которая может расти как в погружённом виде, так и на суше. Листья этого растения полностью редуцированы и функцию фотосинтеза берут на себя стебли. При росте под водой она фотосинтезирует по C3-пути, но на суше переходит к C4-метаболизму вместе с образованием кранц-анатомии — этот процесс контролируется абсцизиновой кислотой. При этом к С4 могут переходить даже просто побеги, оказавшиеся над поверхностью воды[42].
Совмещение C4 и CAM
 |
 |
Метаболизм по типу толстянковых (CAM-фотосинтез) включает в себя некоторые ферменты С4-фотосинтеза, необходимые для нагнетания и концентрирования СО2. Однако в случае САМ-растений предварительная и окончательная фиксация СО2 разделены не в пространстве, а во времени. Тем не менее в течение дня в облигатных CAM-растениях может параллельно работать CAM-путь и классический C3-фотосинтез. Были даже обнаружены виды факультативных CAM-растений (C3-CAM), которые переключались с C3- на CAM-метаболизм только в условиях засухи или засоления. В этом случае внутри одной клетки может протекать C3- и CAM-фотосинтез.
Существует очень мало примеров, когда CAM- и C4-метаболизм протекают в одном растении. Большинство C4-растений представлено злаками, в которых никогда не обнаруживается CAM-фотосинтез, так же как у типичных CAM-растений, таких как орхидеи и бромелиевые, не обнаружен чистый С4-фотосинтез. Только несколько видов растений из рода портулак могут использовать оба пути, к ним относятся Portulaca grandiflora[англ.] и Portulaca mundula[43]. У этих растений CAM-фотосинтез происходит в наполненных соком внутренних клетках стебля и листьев, где запасается вода, в то время как C4-фотосинтез идёт во внешних клетках листа. Таким образом, даже у этих растений оба пути не работают в одной и той же клетке, из чего следует, что CAM- и C4- фотосинтез несовместимы[44].
В качестве объяснения приводятся несколько причин. Например, было бы трудно точно регулировать оба пути из-за их биохимического сходства. К тому же в основе каждого из них лежит разное анатомическое строение и транспортные механизмы, которые имеют важное значение для соответствующей функции, но не могут быть объединены в одной клетке. И, наконец, два одновременных пути концентрации СО2 не обеспечивают экологического преимущества.
C3-C4 переходные формы
Ряд С3-растений обладают типичными морфологическими признаками С4-растений, такими как анатомическая организация листьев с разделением паренхимы на мезофилл и обкладку проводящего пучка, где они могут концентрировать углекислый газ. Кроме того, значение их углекислотного компенсационного пункта находится между таковыми для C3- и C4-растений. В то же время используемый ими механизм концентрирования CO2 совершенно не характерен для C4-растений[45].
Такие растения из-за их анатомического сходства ошибочно назвали C3-C4 переходными формами или «С3-С4-гибридами», хотя такое название в принципе не верно из-за иной биохимии механизма концентрации СО2[46].
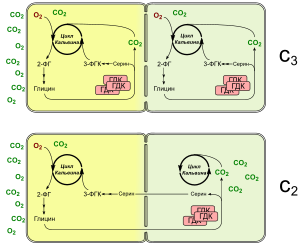
В основе концентрирующего механизма этих растений лежит так называемый С2-фотосинтез, использующий ферменты фотодыхания. Если Рубиско использует в качестве субстрата кислород вместо углекислого газа, образуется 2-фосфогликолат, который перерабатывается в процессе фотодыхания. В пероксисомах гликолат превращается в глицин, две молекулы глицина конденсируются с образованием серина и СО2 с помощью глициндекарбоксилазного комплекса (ГДК). У C3-C4 переходных растений активный ГДК локализуется только в клетках обкладки пучка, так что транспортируемый из мезофилла глицин декарбоксилируется там и обогащает клетки СО2. В клетках мезофилла также экспрессируются белки ГДК, но здесь он не активен, поскольку одна или несколько экспрессируемых субъединиц содержат мутации. Из-за глицин-серинового челнока и транспорта C2-соединений такую форму обмена веществ иногда называют «C2-фотосинтезом». Преимущество такого челночного механизма заключается в том, что СО2 высвобождается не в каждой клетке в отдельности, а концентрируется внутри клеток обкладки. В результате значительно увеличивается шанс для повторного захвата углекислого газа, улучшаются условия работы Рубиско, а значит снижается фотодыхание и связанные с ним затраты энергии.
Подобный механизм, направленный на снижение фотодыхания, обнаружен по крайней мере в следующих восьми семействах высших растений: Aizoaceae, Poaceae, Boraginaceae, Brassicaceae, Asteraceae, Amaranthaceae, Chenopodiaceae и Cleomaceae[47]. У некоторых растений из рода Flaveria[англ.] (Asteraceae) глициновый челнок функционирует наряду с обычным C4-фотосинтезом[47].
Экология
Согласно последним данным C4-фотосинтез независимо возникал по крайней мере 65 раз в 19 различных семействах, и являет собой непревзойдённый пример конвергентной эволюции[48][49]. Во многих родах встречаются как С3-, так и С4-виды.
C4-растения составляют 5 % от общей растительной биомассы и 3 % от общего количества видов растений[50][51]. Ими заселено всего 17 % поверхности Земли, но они осуществляют около 30 % наземного фотосинтеза[52]. Всего известно около 8100 видов[53], использующих C4-путь фиксации углерода, все они относятся к цветковым растениям. Среди двудольных этот путь используют только 4,5 % всех растений, а среди однодольных — 40 %. Несмотря на это, в кладе однодольных C4-растения встречаются только в трёх семействах, в то время как у двудольных — в 16 семействах. Наиболее многочисленная группа C4-растений среди однодольных — это, несомненно, травы; 46 % всех трав используют C4-фотосинтез, что соответствует 60 % всех видов C4-растений. К этой группе относятся такие сельскохозяйственные культуры как кукуруза, сахарный тростник, просо и сорго[54][55]. В кладе двудольных максимальное число C4-видов приходится на порядок Caryophyllales. Из всех семейств Caryophyllales наиболее богато в этом отношении семейство Chenopodiaceae, в котором 550 из 1400 видов используют C4-фотосинтез. Около 250 из 1000 видов близкородственных Amaranthaceae также используют C4-фотосинтез[50][56].
Большинство C4-растений произрастает в тропиках и субтропиках ниже широты 45° в условиях высокой температуры, недостатка воды и обилия солнечного света. Именно в таких климатических условиях они могут успешно конкурировать с C3-растениями благодаря отсутствию фотодыхания. Однако это не означает доминирования С4-метаболизма в засушливых и тёплых условиях. Так, в юго-восточных Каракумах было найдено только четыре вида С4-растений[57]. C4-виды произрастают в умеренно-аридных условиях, когда вода есть, но её не всегда хватает. В экстра-аридных условиях преобладают CAM-растения[58].
Анализ флоры Северной Америки показал, что в Калифорнии С4-растения составляют 4,38 % всех видов, а среди злаков — 82 %, в то время как в районе Великих озёр и Квебеке — только 0,17 % всех видов и 12 % среди злаков. В тропических дождевых лесах С4-виды практически отсутствуют[57]. В калифорнийской же Долине Смерти 70 % всех растущих видов относятся к С4-растениям[58]. Преобладают они и в южных степях и саваннах. С4-виды составляют более двух третей от всех видов трав ниже широты 30°, в то время как выше широты в 50° преобладают С3-травы. На широте 35—38° флора в одинаковой мере богата С3- и С4-видами[59].
В умеренном климате C4-виды в основном активны поздней весной и летом. C3-виды, напротив, активны в течение всего года. В местообитаниях с суровыми зимами C3-виды обычно начинают расти на несколько недель раньше, чем C4-виды.
Как правило, C4-травы редко встречаются в холодных регионах, например, в бореальной зоне между 50-м и 65-м градусом широты или на большой высоте. Исключение составляет зона безлесой альпийской тундры с её сухим климатом. Кроме того, в Тибете была обнаружена C4-трава Orinus thoroldii, растущая на высоте 5200 метров. В целом же они не заходят в полярную и приполярную области (за широту в 65°)[59].
Многие C4-растения устойчивы к холоду, сотни C4-многолетников способны в состоянии покоя переживать мороз до −20 °C. Они прекрасно чувствуют себя даже в районах с умеренным и прохладным климатом, таких как южное побережье Новой Зеландии или прибрежные болота на атлантическом побережье Канады и Соединённого Королевства. В холодных и засушливых условиях произрастают кустарники с С4-фотосинтезом, например, виды рода Atriplex, которые могут вегетировать уже в апреле, при наличии снега и отрицательных температур. Особенно много таких растений в альпийской тундре, где они во множестве встречаются на высоте более 3500 или даже 4800 метров, как это происходит в Андах. При росте на высоте свыше 3500 метров горные C4-виды способны переносить ночные заморозки с отрицательными температурами и эпизодические снегопады, которые здесь могут случится даже в середине лета[59].
Анализ показывает, что такие горные С4-виды растут в определённых точках, часто на юго-восточных склонах между камней, где не бывает ветра, а интенсивный солнечный свет в течение дня может нагревать лист на 10—25 °C выше температуры воздуха, так что фотосинтез протекает при температуре 25—35 °C. Повышение температуры листа днём является обязательным условием для успешной конкуренции таких высокогорных растений с С3-видами[59].
Абиотические факторы

Фотосинтез зависит от ряда абиотических факторов, влияющих друг на друга. Один из таких факторов — концентрация CO2, который фиксируется в процессе фотосинтеза. Если количество света в избытке и само по себе не является ограничивающим фактором, то будет происходить увеличение скорости фотосинтеза с ростом концентрации CO2 в окружающей среде. Этот процесс ограничен — скорость фотосинтеза достигает насыщения, а при достаточно высоких концентрациях даже может снижаться. С другой стороны, при слишком низкой концентрации диоксида углерода его фиксация в ходе фотосинтеза уравновешивается процессами фотодыхания и дыхания. Точка, в которой оба процесса находятся в равновесии, и называется точкой компенсации СО2.
С4-растения обладают эффективным механизмом ассимиляции CO2 через фермент ФЕП-карбоксилазу и слабым фотодыханием, поэтому их точка компенсации CO2 стремится практически к нулю (< 0,001 объёмных процентов CO2[60]). Как видно из графика, скорость фотосинтеза у С4-растений при низком содержании CO2 возрастает значительно быстрее, чем у С3, поэтому при низких концентрациях углекислого газа С4-растения всегда имеют конкурентное преимущество. Для большинства высших C3-растений точка компенсации СО2 находится при довольно высоких концентрациях и составляет 0,005—0,015 % CO2[61] в окружающем воздухе.
С другой стороны, скорость фотосинтеза С4-растений выходит на плато и прекращает расти при содержании CO2 чуть выше его обычной концентрации в воздухе, что связано с полным насыщением фермента ФЕП-карбоксилазы. У С3-растений скорость фотосинтеза продолжает расти и после двукратного увеличения содержания CO2 по сравнению с нормой. Насыщение фотосинтеза у них достигается приблизительно при 0,05—0,10 % CO2[60]. В связи с этим неоднократно высказывалось мнение, что увеличение антропогенных выбросов CO2 сдвигает экологическое равновесие в пользу С3-растений[53].
Как уже упоминалось, благодаря нагнетанию углекислоты С4-растения могут держать устьица в более закрытом положении и значительно экономить воду. Потери воды на транспирацию у С4-растений составляют 250—350 г H2O при увеличении сухого веса растения на 1 г, а у С3 — 450—950 г[25].
У С4-растений световая точка компенсации значительно выше, чем у С3-растений, им требуется гораздо больше света, чтобы полноценно существовать и расти. Тем не менее, при высокой освещенности они намного превосходят С3-растения по интенсивности фотосинтеза и скорости роста[62]. В естественных условиях у С4-растений световое насыщение не достигается, и в ясные дни они используют свет полностью даже в полдень, однако высокая точка световой компенсации накладывает ограничения на их рост в условиях низкой освещённости, то есть их рост ограничивается светом, и только тогда, когда сильный недостаток воды заставляет их закрыть устьица, и, следовательно, снизить потребление углекислого газа, их рост ограничивается концентрацией CO2[63].

Известно, что работа концентрирующего механизма С4-растений требует дополнительных затрат энергии в форме АТФ и НАДФН: 3 молекулы АТФ и 2 молекулы НАДФН на одну молекулу CO2 для С3-пути и 5 молекул АТФ и 2 молекулы НАДФН в случае С4-пути. Как бы то ни было, затраты окупаются, так как при высоких концентрациях CO2 в сайте кабоксилирования оксигеназная реакция в значительной мере подавлена, и потери энергии в фотодыхании значительно снижены. Поэтому С4-метаболизм не обязательно требует больших энергозатрат; на самом деле при повышенных температурах С4-фотосинтез энергетически более выгоден, чем С3-фотосинтез, о чём свидетельствует график температурной зависимости фотосинтеза. Причина этого в том, что поскольку содержание кислорода в атмосфере значительно выше содержания углекислого газа, оксигеназная активность Рубиско с повышением температуры возрастает сильнее, чем карбоксилазная. Поэтому в условиях тёплого климата С4-растения, у которых не только снижена потребность в водоснабжении, но и подавлено фотодыхание, имеют значительное преимущество по сравнению с С3-растениями[64].
Для большинства С3-растений умеренной климатической зоны температурный оптимум фотосинтеза приходится на 25—30 °C. У растений с С4- и CAM-метаболизмом температурный оптимум приходится на 30—35 °C[61].
Кроме того, С4-метаболизм обеспечивает растениям более эффективное использование азота. Благодаря наличию концентрирующего механизма им требуется значительно меньшее количество Рубиско, чем С3-растениям, которые компенсируют низкую концентрацию CO2 в сайте карбоксилирования высоким содержание Рубиско в хлоропластах. Подсчитано, что С4-растению требуется около 13—20 % от количества Рубиско С3-растения для того, чтобы достичь той же скорости фотосинтеза. Свободный азот, который не расходуется на Рубиско, идёт на синтез белков люмена и водорастворимых белков[65]. Подсчитано, что эффективность использования азота в расчёте на площадь листа у С4-растений выше, чем у С3. Это, однако, не означает, что в них содержится меньше азота или что их произрастание приурочено к бедным азотом почвам. Например, используемые для засева газонов С4-травы весьма требовательны к наличию в почве питательных веществ, поскольку эволюционировали в условиях, в которых питательные вещества были в избытке[66].
Ограниченность жизненных форм
За небольшим исключением все С4-растения представлены травами и кустарниками — среди них нет деревьев. В местах преимущественного произрастания С4-растений не образуется лесов и формируется совершенно иной ландшафт. Исключением являются эндемичные для Гавайских островов представители рода Euphorbia, достигающие высоты от 6 до 10 метров. Euphorbia herbstii[англ.] — теневыносливое дерево с острова Оаху, которое растёт в тени других деревьев; Euphorbia olowaluena произрастает в сухих лесных массивах на острове Гавайи. Два других растущих на Гаваях вида, E. remyi[англ.] и E. rockii[англ.], тоже могут становиться маленькими деревьями высотой до 4 метров. Ещё одно исключение из парадигмы отсутствия среди С4-растений деревьев — произрастающий в Казахстане саксаул Haloxylon ammodendron, старые особи которого могут вырасти до 10—12 метров и образуют доминирующий, центральный ствол. Haloxylon ammodendron образует плотные насаждения вдоль рек в Центральной Азии, которые иногда называют лесами в широком смысле этого слова; тем не менее, эти «леса» скорее напоминают высокие заросли кустарников и не являются типичными лесами, как в районах с умеренной влажностью, где деревья могут вырастать свыше 20 метров в высоту[67]
Отсутствие, за небольшим исключением, у деревьев С4-пути, а также низкая представленность С4-растений в подлеске уже давно служит предметом дискуссий. Часто выдвигается гипотеза, что из-за повышенных требований к энергии С4-фотосинтез неэффективен в условиях низкой освещённости. Хотя последние данные показывают, что С4-растения действительно несколько хуже приспособлены к затенению в сравнении с С3-видами, эта разница не столь существенна и не объясняет, почему С4-деревья не смогли сформироваться на более открытых пространствах. Выдвигаются различные объяснения с позиции эволюции, физиологии и экологии, но пока чёткого ответа на этот вопрос нет[67].
Сравнение характеристик C3-, C4- и CAM-растений
| Характеристика | C3 | C4 | CAM |
|---|---|---|---|
| Коэффициент транспирации мл (H2O) на г (C) | 450–900 | 250–350 | 18–100 (ночью) 150–600 (днём) |
| Эффективность использования воды (г сухой массы/г потери воды) | 1,05–2,22 | 2,85–4,00 | 8,0–55,0 |
| Максимальная скорость фотосинтеза (мкмоль CO2/площадь листьев м2 · с) | 20–40 | 30–60 | 5–12 (на свету) 6–10 (в темноте) |
| Температурный оптимум | 15–25 °C | 30–47 °C | 35 °C |
| Прирост сухого вещества (тонн/га · год) | 10–25 | 40–80 | 6–10 |
| δ-13C | от −32 до −20 ‰ | от −17 до −9 ‰ | от −17 до −9 ‰ (засуха) от −32 до −20 ‰ (хорошее снабжение водой) |
Экономическое значение
Среди культурных растений С4-виды (кукуруза, сорго, некоторые виды проса, сахарный тростник) имеют большее значение, чем среди дикорастущих, их продуктивность составляет от 33 % (с учётом остатков, не используемых по прямому назначению, как, например, солома злаков, стебли и листья корнеплодов) до 38 % суммарной продуктивности основных сельскохозяйственных культур[70]. Также у этих растений наблюдаются более высокие скорости роста. В оптимальных условиях орошения и удобрения посевы кукурузы и сахарного тростника являются самыми продуктивными из известных агроценозов[71]. К C4-растениям также относятся и наиболее устойчивые сорняки, включая 8 из 10 самых злостных сорняков, например, свинорой пальчатый и куриное просо[72].
C4-растения также могут быть использованы для производства биотоплива, как например кукуруза в США или сахарный тростник в Бразилии. В качестве альтернативы также рассматривается вариант выращивания холодостойких C4-злаков, таких как просо, для производства целлюлозного этанола. Например, урожайность холодоустойчивых злаков из рода Мискантус составляет 15—29 тонн сухого вещества на гектар в год[65].
Одной из проблем, связанных с ростом населения мира, является истощение запасов продовольствия, тем более, что количество доступных для обработки пахотных земель неуклонно снижается. Один из способов увеличения урожайности — использование С4-фотосинтеза. Простейший из возможных подходов заключается в изменении диких, не культивируемых С4-видов с целью создания на их основе новой сельскохозяйственной культуры. Например, методами селекции из куриного проса можно было бы вывести рисоподобное культурное растение[73].
Альтернативный подход заключается во внедрении С4-пути в существующие культурные С3-растения методами генной инженерии. В качестве главных кандидатов на подобное преобразование рассматриваются рис, который служит хлебной культурой для половины Земного шара, и соя, способная к симбиотической азотофиксации. Для работы в этом направлении был собран большой международный проект, организованный на базе Международного института исследования риса[англ.] на Филиппинах, под названием «Проект С4-рис», в который входят 12 лабораторий из восьми стран. В декабре 2015 года проект объявил о создании культивара риса с рудиментарной формой C4-фотосинтеза. В клетки этого сорта удалось встроить все основные ферменты С4-пути, хотя созданные растения пока по большей части полагаются на С3-фотосинтез. Тем не менее, этот результат показал принципиальную возможность протекания С4-цикла в рисе[74].
По состоянию на сегодняшний день все попытки запустить С4-цикл в рамках одной клетки путём простого внедрения соответствующих ферментов либо провалились, либо оказались крайне малоэффективными. Причиной многих ранних провалов послужило отсутствие в трансформируемых растениях описанных выше белков-регуляторов главных ферментов С4-метаболизма, которые обеспечили бы их настройку в соответствии с уровнем освещённости и энергетическим состоянием клетки, а также необходимых для правильной экспрессии ключевых белков регуляторных генетических последовательностей. Другим серьёзным препятствием является отсутствие в такой схеме каких-либо преград против вытекания CO2 из клетки. Наиболее очевидным решением стало бы создание полноценной кранц-анатомии, однако на данный момент гены, ответственные за развитие такого строения, остаются неизвестными, а их поиск остаётся приоритетным направлением[73].
Эволюция
Согласно современным геологическим данным С4-фотосинтез возник в олигоцене около 30 миллионов лет назад[48]. Этот период характеризуется падением температуры и концентрации диоксида углерода (с 1000 ppm (частей на миллион) до примерно 300 ppm). Кроме того, атмосферная концентрация О2 увеличилась с 18% до 21%. Сложились крайне неблагоприятные для С3-фотосинтеза условия, способствовавшие высокой интенсивности фотодыхания. Предполагается, что именно низкая доступность CO2 явилась причиной начала отбора растений с нагнетающими механизмами, что в конечном итоге привело к появлению C4- и CAM-путей современного типа. Кроме того, климат того времени стал более засушливым, появились открытые пространства с высокой освещённостью (степи, пусты, прерии, пампы, саванны). Также усилилась сезонность климата и частота пожаров, что также, вероятно, сыграло значительную роль в отборе признаков C4- и CAM-видов[75].
Уменьшение концентрации СО2 считается важным эволюционным триггером и общей предпосылкой для формирования C4-растений, но не обязательно основной. Поскольку C4-фотосинтез развивался в течение 30 миллионов лет с момента его первого появления, важную роль несомненно сыграли локальные факторы. Существует шесть глобальных центров, которые рассматриваются в качестве ядра для многих C4-эвдикот и некоторых злаков: Северная Америка, Южная Америка, Южная Африка, Восточная Африка и Аравия, Центральная Азия и Австралия. Это тёплые и сухие регионы с умеренно-аридным климатом и регулярными осадками в течение лета. Солёные, песчаные или сухие почвы способствовали возникновению и распространению C4-растений, другим благоприятным фактором стал высокий уровень инсоляции. Около 23 млн лет назад C4-растения были уже широко распространены в Африке, Америке и Южной Азии. Распространение происходило постепенно, особенно в области низких и средних широт[49].
Глобальное, экологическое значение этот тип фотосинтеза приобрёл только после широкого распространением C4-злаков и расширения влияния C4-растений в луговых экосистемах и саваннах. Это произошло в конце миоцена и начале плиоцена около 2—8 миллионов лет назад. Остаётся спорным, явилось ли снижение концентрации СО2 в атмосфере глобальным общим фактором для такого распространения (по крайней мере, он — важная к тому предпосылка). Другими причинами вполне могли послужить изменение климата, появление крупных травоядных и увеличение частоты лесных пожаров[76].
Этапы формирования C4-метаболизма
С эволюционной точки зрения превращение C3-растений в C4 — довольно несложный процесс: все необходимые структурные элементы и ферменты уже присутствуют у C3-растений. Например, ферменты ФЕП-карбоксилаза и хлоропластная НАДФ-малатдегидрогеназа в норме присутствуют в замыкающих клетках C3-растений, где обеспечивают синтез ионов малата, необходимых для открывания устьичной щели. Аналогичным образом все растения обладают изоформами малик-энзима, которые располагаются в цитозоле, хлоропластах или митохондриях и в норме обеспечивают анаплеротические пути метаболизма.
Сильная кластеризация С4-видов в рамках определённых групп, например, клады PACMAD, внутри которой С4-фотосинтез возникал около 18 раз[49], указывает на то, что не все С3-растения одинаково хорошо подходят для возникновения C4-фотосинтеза, и что для этого необходимы благоприятные преадаптации.
На сегодняшний момент процесс становления C4-метаболизма представляется следующим образом: на первом этапе происходило накопление благоприятных преадаптаций, таких как высокое число жилок в листе, а также полногеномное удвоение, в результате которого возникли копии генов, необходимых для С4-пути. В дальнейшем эти копии прошли соответствующую специализацию. На втором этапе происходило последовательное образование протокранц-анатомии: увеличивались в размере клетки обкладки, в них возросло число органелл, произошло смещение и кластеризация митохондрий и хлоропластов. Предполагается, что такие преобразования могли быть выгодны растению, поскольку привели к появлению одноклеточного глицинового шаттла, который позволил растению высвобождать CO2 из метаболитов фотодыхания в непосредственной близости от хлоропластов. Подобные растения встречаются в природе, их точка компенсации CO2 на 5—15 % ниже, чем у типичных C3-растений. На третьем этапе произошло возникновение полноценного C2-фотосинтеза: снизилось число клеток мезофилла по отношению к клеткам обкладки пучка, произошла инактивация ГДК в клетках мезофилла. На четвёртом этапе на основе этих растений возник полноценный C4-фотосинтез. Предположение о возникновении С4-видов из С3-С4 переходных форм возникли, в частности, на основании того, что у части последних активность ФЕП-карбоксилазы, ПФДК и НАДФ-МЭ в 2—5 раз выше, чем у C3-видов. В ходе заключительного, пятого этапа, происходила оптимизация и тонкая настройка нового концентрирующего механизма для максимально эффективного действия, что и привело в конечном итоге к появлению полноценных C4-растений. Должно было произойти усиление экспрессии ключевых ферментов и возникновение необходимых регуляторных механизмов, улучшение кинетических качеств ФЕП-карбоксилазы, снижение экспрессии Рубиско в клетках мезофилла и смена режима работы устьиц[77].
См. также
Примечания
- ↑ Ермаков, 2005, с. 196.
- ↑ Ермаков, 2005, с. 198.
- ↑ Hugo P. Kortschak, Constance E. Hartt, George O. Burr. Carbon Dioxide Fixation in Sugarcane Leaves (англ.) // Plant Physiology. — American Society of Plant Biologists, 1965. — March (vol. 40, no. 2). — P. 209—213.
- ↑ 1 2 3 4 5 6 Discoveries in Plant Biology / Editors: Shain-dow Kung,Shang-Fa Yang. — Chapter 13; M.D. Hatch and C.R. Slack: C4 Photosynthesis: Discovery, Resolution, Recognition, and Significance, 1998. — Vol. 1. — P. 175-196. — ISBN 981-02-1313-1. Архивировано 23 сентября 2016 года.
- ↑ Полевой В. В. Физиология растений. — Высшая школа. — Москва, 1989. — С. 93. — 446 с. — ISBN 5-06-001604-8.
- ↑ Карпилов Ю.С. Распределение радиоактивного углерода 14C среди продуктов фотосинтеза кукурузы // Труды Казанского сельскохозяйственного института. — 1960. — Т. 41, № 1. — С. 15—24.
- ↑ M. D. Hatch and C. R. Slack. Photosynthesis by sugar-cane leaves. A new carboxylation reaction and the pathway of sugar formation (англ.) // Biochem.J. : journal. — 1966. — Vol. 101, no. 1. — P. 103—111. — PMID 5971771.
- ↑ Медведев, 2013, с. 57.
- ↑ Страсбургер, 2008, с. 140-142.
- ↑ Страсбургер, 2008, с. 140.
- ↑ Donat-Peter Häder: Photosynthese, 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 205.
- ↑ Centrifugal versus centripetal chloroplasts. Plants in Action. Australian and New Zealand societies of plant sciences. Дата обращения: 22 августа 2016. Архивировано 29 мая 2017 года.
- ↑ 1 2 3 4 5 6 Хелдт, 2011, с. 188.
- ↑ 1 2 Хелдт, 2011, с. 185.
- ↑ Хелдт, 2011, с. 147.
- ↑ Страсбургер, 2008, с. 144.
- ↑ Evans, H.J. The Mechanism of the Pyruvate, Phosphate Dikinase Reaction (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1968. — Vol. 61, no. 4. — P. 1448—1453. — doi:10.1073/pnas.61.4.1448. — PMID 4303480. — PMC 225276.
- ↑ 1 2 Ермаков, 2005, с. 197.
- ↑ 1 2 Yu Wang, Andrea Bräutigam, Andreas P. M. Weber and Xin-Guang Zhu. Three distinct biochemical subtypes of C4 photosynthesis? A modelling analysis (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2014. — Vol. 65, no. 13. — P. 3567—3578. — doi:10.1093/jxb/eru058.
- ↑ 1 2 Кобак, 1988, с. 20.
- ↑ 1 2 3 4 Страсбургер, 2008, с. 146.
- ↑ Хелдт, 2011, с. 190.
- ↑ Gerry Edwards,David Walker. C3, C4: Mechanisms, and Cellular and Environmental Regulation, of Photosynthesis. — Univ of California Pr, 1983. — 552 с. — ISBN 978-0520050181.
- ↑ Donat-Peter Häder: Photosynthese, 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 207.
- ↑ 1 2 3 Медведев, 2013, с. 59.
- ↑ 1 2 3 Sage, RF., Sage, TL. und Kocacinar, F. (2012): Photorespiration and the evolution of C4 photosynthesis. In: Annu Rev Plant Biol. 63; S. 19-47; PMID 22404472; doi:10.1146/annurev-arplant-042811-105511.
- ↑ Raghavendra, Sage, 2011, Chapter 4; Gerald E. Edwards, Elena V. Voznesenskaya: C4 Photosynthesis: Kranz forms and single-cell C4 in terrestrial plants., pp. 29–61.
- ↑ 1 2 Хелдт, 2011, с. 194.
- ↑ Gonzalez, Daniel H.; Iglesias, Alberto A.; Andreo, Carlos S. Active-site-directed inhibition of phosphoenolpyruvate carboxylase from maize leaves by bromopyruvate (англ.) // Archives of Biochemistry and Biophysics[англ.] : journal. — Elsevier, 1986. — Vol. 245, no. 1. — P. 179—186. — ISSN 0003-9861. — doi:10.1016/0003-9861(86)90203-1. — PMID 3947097.
- ↑ 1 2 Nimmo, Hugh G. The regulation of phosphoenolpyruvate carboxylase in CAM plants (англ.) // Trends in Plant Science[англ.] : journal. — Cell Press, 2000. — Vol. 5, no. 2. — P. 75—80. — ISSN 1360-1385. — doi:10.1016/S1360-1385(99)01543-5. — PMID 10664617.
- ↑ José A. Monreal, Fionn McLoughlin, Cristina Echevarría, Sofía García-Mauriño and Christa Testerink. Phosphoenolpyruvate Carboxylase from C4 Leaves Is Selectively Targeted for Inhibition by Anionic Phospholipids (англ.) // Plants Physiology : journal. — February 2010. — Vol. 152, no. 2. — P. 634—638. — doi:10.1104/pp.109.150326.
- ↑ Kai, Yasushi; Matsumura, Hiroyoshi; Izui, Katsura. Phosphoenolpyruvate carboxylase: three-dimensional structure and molecular mechanisms (англ.) // Archives of Biochemistry and Biophysics[англ.] : journal. — Elsevier, 2003. — Vol. 414, no. 2. — P. 170—179. — ISSN 0003-9861. — doi:10.1016/S0003-9861(03)00170-X. — PMID 12781768.
- ↑ Chris J. Chastain, Raymond Chollet. Regulation of pyruvate, orthophosphate dikinase by ADP-/Pi-dependent reversible phosphorylation in C3 and C4 plants (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, June 2003. — Vol. 41, no. 6—7. — P. 523—532. — doi:10.1016/S0981-9428(03)00065-2. Архивировано 12 октября 2016 года.
- ↑ Кобак, 1988, с. 21.
- ↑ Freitag, H; Stichler, W. A remarkable new leaf type with unusual photosynthetic tissue in a central Asiatic genus of Chenopodiaceae (англ.) // Plant Biol : journal. — 2000. — Vol. 2. — P. 154—160. — doi:10.1055/s-2000-9462.
- ↑ Voznesenskaya, Elena; Vincent R. Franceschi; Olavi Kiirats; Elena G. Artyusheva; Helmut Freitag; Gerald E. Edwards. Proof of C4 photosynthesis without Kranz anatomy in Bienertia cycloptera (Chenopodiaceae) (англ.) // The Plant Journal[англ.] : journal. — 2002. — Vol. 31, no. 5. — P. 649—662. — doi:10.1046/j.1365-313X.2002.01385.x. — PMID 12207654.
- ↑ Akhani, Hossein; Barroca, João; Koteeva, Nuria; Voznesenskaya, Elena; Franceschi, Vincent; Edwards, Gerald; Ghaffari, Seyed Mahmood; Ziegler, Hubert. Bienertia sinuspersici (Chenopodiaceae): A New Species from Southwest Asia and Discovery of a Third Terrestrial C4 Plant Without Kranz Anatomy (англ.) // Systematic Botany : journal. — 2005. — Vol. 30, no. 2. — P. 290—301. — doi:10.1600/0363644054223684.
- ↑ Akhani, H; Chatrenoor, T; Dehghani, M; Khoshravesh, R; Mahdavi, P.; Matinzadeh, Z. A new species of Bienertia (Chenopodiaceae) from Iranian salt deserts: a third species of the genus and discovery of a fourth terrestrial C4 plant without Kranz anatomy (англ.) // Plant Biosystems : journal. — 2012. — Vol. 146. — P. 550—559. — doi:10.1080/11263504.2012.662921.
- ↑ 1 2 3 4 Richard M. Sharpe, Sascha Offermann. One decade after the discovery of single-cell C4 species in terrestrial plants: what did we learn about the minimal requirements of C4 photosynthesis? (англ.) // Photosynth Reasrch : journal. — 2014. — Vol. 119, no. 169. — doi:10.1007/s11120-013-9810-9.
- ↑ J.B. Reiskind, G. Bowes. The role of phosphoenolpyruvate carboxykinase in a marine macroalga with C4 photosynthetic characteristics (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — Vol. 88, no. 7. — P. 2883—2887. — doi:10.1073/pnas.88.7.2883.
- ↑ Reinfelder J.R., Kraepiel A.M., Morel FM. Unicellular C4 photosynthesis in a marine diatom (англ.) // Nature. — 2000. — Vol. 407, no. 6807. — P. 996—999. — doi:10.1038/35039612. — PMID 11069177.
- ↑ 1 2 Richard C. Leegood. C4 photosynthesis: principles of CO2 concentration and prospects for its introduction into C3 plants (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2002. — Vol. 53, no. 369. — P. 581—590. — doi:10.1093/jexbot/53.369.581.
- ↑ Hans Lambers, F. Stuart Chapin III. und Thijs L. Pons: Plant Physiological Ecology. 2. Auflage, Springer, Berlin 2008; ISBN 978-0-387-78340-6; S. 80.
- ↑ Sage, RF. (2002): Are crassulacean acid metabolism and C4 photosynthesis incompatible? In: Functional Plant Biology 29(6); S. 775—785; doi:10.1071/PP01217.
- ↑ Raghavendra, Sage, 2011, Chapter 7; Stanislav Kopriva: Nitrogen and Sulfur Metabolism in C4 Plants., p. 110.
- ↑ Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik — Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 781—782.
- ↑ 1 2 Raghavendra, Sage, 2011, Chapter 6; Bauwe H.: Photorespiration: the bridge to C4 photosynthesis., p. 95, 132.
- ↑ 1 2 Rowan F. Sage, Matt Stata. Photosynthetic diversity meets biodiversity: The C4 plant example (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2015. — Vol. 172. — P. 104—119. — doi:10.1016/j.jplph.2014.07.024.
- ↑ 1 2 3 Rowan F. Sage, Pascal-Antoine Christin and Erika J. Edwards. The C4 plant lineages of planet Earth (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2011. — Vol. 62, no. 9. — P. 3155—3169. — doi:10.1093/jxb/err048.
- ↑ 1 2 Sage, Rowan; Russell Monson. 7 // C4 Plant Biology (неопр.). — 1999. — С. 228—229. — ISBN 0-12-614440-0.
- ↑ Bond, W. J.; Woodward, F. I.; Midgley, G. F. The global distribution of ecosystems in a world without fire (англ.) // New Phytologist[англ.] : journal. — 2005. — Vol. 165, no. 2. — P. 525—538. — doi:10.1111/j.1469-8137.2004.01252.x. — PMID 15720663.
- ↑ Osborne, C. P.; Beerling, D. J. Nature's green revolution: the remarkable evolutionary rise of C4 plants (англ.) // Philosophical Transactions of the Royal Society B: Biological Sciences : journal. — 2006. — Vol. 361, no. 1465. — P. 173—194. — doi:10.1098/rstb.2005.1737. — PMID 16553316. — PMC 1626541.
- ↑ 1 2 Rowan F. Sage. A portrait of the C4 photosynthetic family on the 50th anniversary of its discovery: species number, evolutionary lineages, and Hall of Fame (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2016. — Vol. 67, no. 14. — P. 4039—4056. — doi:10.1093/jxb/erw156.
- ↑ Sage Rowan, Russell Monson. 16 // C4 Plant Biology (неопр.). — 1999. — С. 551—580. — ISBN 0-12-614440-0.
- ↑ Zhu X.G., Long S.P., Ort D.R. What is the maximum efficiency with which photosynthesis can convert solar energy into biomass? (англ.) // Current Opinion in Biotechnology : journal. — Elsevier, 2008. — Vol. 19, no. 2. — P. 153—159. — doi:10.1016/j.copbio.2008.02.004. — PMID 18374559.
- ↑ Kadereit, G; Borsch, T; Weising, K; Freitag, H. Phylogeny of Amaranthaceae and Chenopodiaceae and the Evolution of C4 Photosynthesis (англ.) // International Journal of Plant Sciences : journal. — 2003. — Vol. 164, no. 6. — P. 959—986. — doi:10.1086/378649.
- ↑ 1 2 Кобак, 1988, с. 23.
- ↑ 1 2 Страсбургер, 2008, с. 145.
- ↑ 1 2 3 4 Raghavendra, Sage, 2011, Chapter 10; Rowan F. Sage, Ferit Kocacinar, David S. Kubien: C4 Photosynthesis and Temperature., p. 170.
- ↑ 1 2 Ulrich Lüttge, Manfred Kluge: Botanik — Die einführende Biologie der Pflanzen. 6. aktualisierte Auflage, Wiley-VCH, 2012, ISBN 978-3527331925, S. 498.
- ↑ 1 2 Ермаков, 2005, с. 204.
- ↑ Linder Biologie Gesamtband, Schroedel, 22. Auflage, Braunschweig, 2005, S. 56
- ↑ Страсбургер, 2008, с. 151.
- ↑ Хелдт, 2011, с. 186.
- ↑ 1 2 Raghavendra, Sage, 2011, Chapter 19; Michael B. Jones: C4 species as energy crops., pp. 379–397.
- ↑ Joseph Craine. Why be efficient? A question for C4 plants. Wild Plants Post (11 ноября 2009). Дата обращения: 8 сентября 2016. Архивировано 31 марта 2017 года.
- ↑ 1 2 Rowan F. Sage, Stefanie Sultmanis. Why Are There No C4 Forests? (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2016. — doi:10.1016/j.jplph.2016.06.009.
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8; S. 485.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5; S. 136.
- ↑ Кобак, 1988, с. 26.
- ↑ Donat-Peter Häder: Photosynthese, 1. Auflage, Thieme Verlag, Stuttgart 1999, ISBN 978-3-13-115021-9, S. 214.
- ↑ Хелдт, 2011, с. 195.
- ↑ 1 2 Raghavendra, Sage, 2011, Chapter 18; James N. Burnell: Hurdles to Engineering Greater Photosynthetic Rates in Crop Plants: C4 Rice., p. 363.
- ↑ Bullis, Kevin Speeding Plant Growth to Feed the World | MIT Technology Review. MIT Technology Review (декабрь 2015). Дата обращения: 30 декабря 2015. Архивировано 29 января 2016 года.
- ↑ Ulrich Lüttge, Manfred Kluge und Gerhard Thiel: Botanik — Die umfassende Biologie der Pflanzen. 1. Auflage, Wiley-VCH Verlag GmbH & Co. KGaA; Weinheim 2010; ISBN 978-3-527-32030-1; S. 797.
- ↑ Raghavendra, Sage, 2011, Chapter 17; Colin P. Osborne: The geologic history of C4 plants, pp. 339–357.
- ↑ Sage R.F.; Sage T.L.; Kocacinar F. Photorespiration and the Evolution of C4 Photosynthesis (англ.) // Annu Rev Plant Biol. : journal. — 2012. — Vol. 63, no. 19. — P. 19—47. — doi:10.1146/annurev-arplant-042811-105511. — PMID 22404472.
Литература
На русском
- П. Зитте, и др. на основе учебника Э. Страсбургера. Ботаника / Под ред. В. В. Чуба. — 35-е изд. — М.: Академия, 2008. — Т. 2. Физиология растений. — 495 с.
- Медведев С. С. Физиология растений. — СПб.: БХВ-Петербург, 2013. — 335 с.
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.
- Хелдт Г. В. Биохимия растений. — М.: БИНОМ. Лаборатория знаний, 2011. — 471 с.
- К.И.Кобак. Биотические компоненты углеродного цикла / Под ред. М.И. Будыко. — Ленинград: Гидрометеоиздат, 1988. — 246 с. — ISBN 5-286-00055-X.
На английском
- C4 Photosynthesis and Related CO2 Concentrating Mechanisms / Editors: Agepati S. Raghavendra and Rowan F. Sage. — Springer, 2011. — Vol. 32. — 424 p. — (Advances in Photosynthesis and Respiration). — ISBN 978-90-481-9407-0. — doi:10.1007/978-90-481-9407-0.
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |


