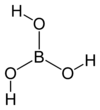
Борна киселина
| Борна киселина | |||
|---|---|---|---|
 |
 | ||

| |||
| ИУПАЦ име |
| ||
| Идентификација | |||
| ЦАС регистарски број | 10043-35-3 | ||
| ПубЦхем[1][2] | 7628 | ||
| ЦхемСпидер[3] | 7346 | ||
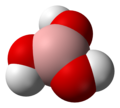
| Јмол-3Д слике | Слика 1 | ||
| |||
| |||
| Својства | |||
| Молекулска формула | Х3БО3 | ||
| Моларна маса | 61.83 г мол−1 | ||
| Агрегатно стање | Кристал бијеле боје | ||
| Густина | 1.435 г/цм3 | ||
| Тачка топљења |
170.9 °Ц, 444 К, 340 °Ф | ||
| Тачка кључања |
300 °Ц, 573 К, 572 °Ф | ||
| Растворљивост у води | 2.52 г/100 мЛ (0 °Ц) 4.72 г/100 мЛ (20 °Ц) 5.7 г/100 мЛ (25 °Ц) 19.10 г/100 мЛ (80 °Ц) 27.53 г/100 мЛ (100 °Ц) | ||
| Растворљивост у отхер солвентс | Растворљива у нижим алкохолима умјерено растворљива у пиридину врло мало растворљива у ацетону | ||
| пКа | 5.2 | ||
| Опасност | |||
| НФПА 704 | |||
| Тачка паљења | Незапаљива | ||
| ЛД50 | 2660 мг/кг, орално (пацов) | ||
| Сродна једињења | |||
| Сродна једињења | Бор триоксид Боракс | ||
|
Уколико није другачије напоменуто, подаци се односе на стандардно стање (25 °Ц, 100 кПа) материјала | |||
| Инфобоx референцес | |||
Борна киселина (хемијска формула Х3БО3 или Б(ОХ)3) је супстанца која спада у слабе неорганске киселине. Постоји у облику безбојних кристала или бијелог праха и растворљива је у води. Може се наћи и у минералном облику и тада се назива сасолит. У природи се може наћи у неким вулканским областима, у саставу разних минерала (нпр. боракс), у морској води, у биљкама и воћу.
Кристална структура
[уреди | уреди извор]Молекул борне киселине Б(ОХ)3 је планаран. Атом бора у молекулу борне киселине је сп2 хибридизован, тј. три сп2 хибридне орбитале се налазе у истој равни а угао између њих је 120 °. Бор са кисеоником гради ковалентне везе (посредством сп2 орбитала) и због тога је цијели молекул планаран . Борна киселина се у чврстом стању састоји од слојева Б(ОХ)3 молекула које на окупу држи водонична веза. Растојање између два сусједна слоја је 318 пм.
 |
 |
доводи да молекули борне киселине формирају паралелне слојеве у чврстом стању |
Добијање
[уреди | уреди извор]Борна киселина се може добити у реакцији између боракса и неке неорганске киселине, као нпр. хлороводоничне киселине:
- На2Б4О7·10Х2О + 2 ХЦл → 4 Б(ОХ)3 [ор Х3БО3] + 2 НаЦл + 5 Х2О
Особине
[уреди | уреди извор]Борна киселина је растворљива у кључалој води. При загријавању изнад 170 °Ц долази до реакције дехидратације при чему настаје борична киселина (ХБО2):
- Х3БО3 → ХБО2 + Х2О
Борична киселина је бијела, кристална супстанца и дјелимично је растворљива у води. Топи се на 236 °Ц а при загријавању преко 300 °Ц долази до даљње дехидратације при чему се формира тетраборична киселина или пироборична киселина:
- 4 ХБО2 → Х2Б4О7 + Х2О
Даљњим загријавањем добија се бор(III)-оксид:
- Х2Б4О7 → 2 Б2О3 + Х2О
Борна киселина дисосује у воденом раствору:
- Б(ОХ)3 + Х2О
 Б(ОХ)4- + Х+ (Ка = 5.8x10−10 мол/л; пКа = 9.24)
Б(ОХ)4- + Х+ (Ка = 5.8x10−10 мол/л; пКа = 9.24)
При томе се борна киселина понаша као Луисова киселина, тј. реагује са молекулом воде и прима електронски пар од ОХ- групе, што је чини киселином по Луисовој теорији. Награђени Б(ОХ)4- јон има тетраедарски облик, тј. тетраедарски распоред атомских група око атома бора.
У растворима са пХ вриједношћу 7-10, и ако је концентрација бора већа од 0.025 мол/L долази до стварања полиборатних јона. Најпознатији је тетраборатни јон који се налази у минералу бораксу:
- 4Б(ОХ)4- + 2 Х+
 Б4О72- + 9 Х2О
Б4О72- + 9 Х2О
Примјена
[уреди | уреди извор]Борна киселина налази примјену као антисептик, инсектицид, за спрјечавање ширења ватре итд. У индустрији налази примјену у производњи фибергласа, за прављење средстава за подмазивање дрвета. Користи се и у пиротехници.
Референце
[уреди | уреди извор]- ↑ Ли Q, Цхенг Т, Wанг Y, Брyант СХ (2010). „ПубЦхем ас а публиц ресоурце фор друг дисцоверy.”. Друг Дисцов Тодаy 15 (23-24): 1052-7. ДОИ:10.1016/j.drudis.2010.10.003. ПМИД 20970519.
- ↑ Еван Е. Болтон, Yанли Wанг, Паул А. Тхиессен, Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy 4: 217-241. ДОИ:10.1016/S1574-1400(08)00012-1.
- ↑ Хеттне КМ, Wиллиамс АЈ, ван Муллиген ЕМ, Клеињанс Ј, Ткацхенко V, Корс ЈА. (2010). „Аутоматиц вс. мануал цуратион оф а мулти-соурце цхемицал дицтионарy: тхе импацт он теxт мининг”. Ј Цхеминформ 2 (1): 3. ДОИ:10.1186/1758-2946-2-3. ПМИД 20331846.
