COL11A2
Kolagenski lanac alfa-2(XI) jest protein koji je kod ljudi kodiran genom COL11A2.[5][6][7]
Aminokiselinska sekvenca
[uredi | uredi izvor]Dužina polipeptidnog lanca je 1.736 aminokiselina, а molekulska težina 171.791 Da.[8]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MERCSRCHRL | LLLLPLVLGL | SAAPGWAGAP | PVDVLRALRF | PSLPDGVRRA | ||||
| KGICPADVAY | RVARPAQLSA | PTRQLFPGGF | PKDFSLLTVV | RTRPGLQAPL | ||||
| LTLYSAQGVR | QLGLELGRPV | RFLYEDQTGR | PQPPSQPVFR | GLSLADGKWH | ||||
| RVAVAVKGQS | VTLIVDCKKR | VTRPLPRSAR | PVLDTHGVII | FGARILDEEV | ||||
| FEGDVQELAI | VPGVQAAYES | CEQKELECEG | GQRERPQNQQ | PHRAQRSPQQ | ||||
| QPSRLHRPQN | QEPQSQPTES | LYYDYEPPYY | DVMTTGTTPD | YQDPTPGEEE | ||||
| EILESSLLPP | LEEEQTDLQV | PPTADRFQAE | EYGEGGTDPP | EGPYDYTYGY | ||||
| GDDYREETEL | GPALSAETAH | SGAAAHGPRG | LKGEKGEPAV | LEPGMLVEGP | ||||
| PGPEGPAGLI | GPPGIQGNPG | PVGDPGERGP | PGRAGLPGSD | GAPGPPGTSL | ||||
| MLPFRFGSGG | GDKGPVVAAQ | EAQAQAILQQ | ARLALRGPPG | PMGYTGRPGP | ||||
| LGQPGSPGLK | GESGDLGPQG | PRGPQGLTGP | PGKAGRRGRA | GADGARGMPG | ||||
| DPGVKGDRGF | DGLPGLPGEK | GHRGDTGAQG | LPGPPGEDGE | RGDDGEIGPR | ||||
| GLPGESGPRG | LLGPKGPPGI | PGPPGVRGMD | GPQGPKGSLG | PQGEPGPPGQ | ||||
| QGTPGTQGLP | GPQGAIGPHG | EKGPQGKPGL | PGMPGSDGPP | GHPGKEGPPG | ||||
| TKGNQGPSGP | QGPLGYPGPR | GVKGVDGIRG | LKGHKGEKGE | DGFPGFKGDI | ||||
| GVKGDRGEVG | VPGSRGEDGP | EGPKGRTGPT | GDPGPPGLMG | EKGKLGVPGL | ||||
| PGYPGRQGPK | GSLGFPGFPG | ASGEKGARGL | SGKSGPRGER | GPTGPRGQRG | ||||
| PRGATGKSGA | KGTSGGDGPH | GPPGERGLPG | PQGPNGFPGP | KGPLGPPGKD | ||||
| GLPGHPGQRG | EVGFQGKTGP | PGPPGVVGPQ | GAAGETGPMG | ERGHPGPPGP | ||||
| PGEQGLPGTA | GKEGTKGDPG | PPGAPGKDGP | AGLRGFPGER | GLPGTAGGPG | ||||
| LKGNEGPSGP | PGPAGSPGER | GAAGSGGPIG | PPGRPGPQGP | PGAAGEKGVP | ||||
| GEKGPIGPTG | RDGVQGPVGL | PGPAGPPGVA | GEDGDKGEVG | DPGQKGTKGN | ||||
| KGEHGPPGPP | GPIGPVGQPG | AAGADGEPGA | RGPQGHFGAK | GDEGTRGFNG | ||||
| PPGPIGLQGL | PGPSGEKGET | GDVGPMGPPG | PPGPRGPAGP | NGADGPQGPP | ||||
| GGVGNLGPPG | EKGEPGESGS | PGIQGEPGVK | GPRGERGEKG | ESGQPGEPGP | ||||
| PGPKGPTGDD | GPKGNPGPVG | FPGDPGPPGE | GGPRGQDGAK | GDRGEDGEPG | ||||
| QPGSPGPTGE | NGPPGPLGKR | GPAGSPGSEG | RQGGKGAKGD | PGAIGAPGKT | ||||
| GPVGPAGPAG | KPGPDGLRGL | PGSVGQQGRP | GATGQAGPPG | PVGPPGLPGL | ||||
| RGDAGAKGEK | GHPGLIGLIG | PPGEQGEKGD | RGLPGPQGSP | GQKGEMGIPG | ||||
| ASGPIGPGGP | PGLPGPAGPK | GAKGATGPGG | PKGEKGVQGP | PGHPGPPGEV | ||||
| IQPLPIQMPK | KTRRSVDGSR | LMQEDEAIPT | GGAPGSPGGL | EEIFGSLDSL | ||||
| REEIEQMRRP | TGTQDSPART | CQDLKLCHPE | LPDGEYWVDP | NQGCARDAFR | ||||
| VFCNFTAGGE | TCVTPRDDVT | QFSYVDSEGS | PVGVVQLTFL | RLLSVSAHQD | ||||
| VSYPCSGAAR | DGPLRLRGAN | EDELSPETSP | YVKEFRDGCQ | TQQGRTVLEV | ||||
| RTPVLEQLPV | LDASFSDLGA | PPRRGGVLLG | PVCFMG |
Pregled
[uredi | uredi izvor]Gen COL11A2 proizvodi jednu komponentu ovog tipa kolagena, zvanog lanac pro-alfa2 (XI). Kolagen tipa XI dodaje strukturu i snagu tkivima koja podržavaju tjelesne mišiće, zglobove, organa i kožađe ( vezivno tkivo). Kolagen tipa XI obično se nalazi u hrskavicama kao i u tekućini koja ispunjava očnu jabučicu, unutrašnjem uhu i središnjem dijelu diskova između pršljenova u kičmi (nucleus pulposus). Kolagen tipa XI također pomaže u održavanju razmaka i promjera kolagenih vlakana tipa II. Kolagen tipa II važna je komponenta oka i zrelog hrskavičavog tkiva. Veličina i raspored kolagenih fibrila tipa II ključni su za normalnu strukturu ovih tkiva.
Lanac pro-alfa2 (XI) kombinira se sa lancima pro-alfa1 (XI) i pro-alfa1 (II) kolagena, kako bi formirao molekulu prokolagena. Ove trolančane molekule, slične užetu moraju biti obrađene enzimima u ćeliji. Nakon obrade, te molekule prokolagena napuštaju ćeliju i raspoređuju se u dugačke, tanke vlakna koja se međusobno umrežavaju u prostorima oko ćelija. Ukrštene veze rezultiraju stvaranjem vrlo snažnih zrelih vlakana kolagena tipa XI.
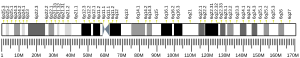
Gen COL11A2 nalazi se na kratkom (p) kraku hromosoma 6, na poziciji 21.3, od bp 33,238.446 do baznog para 33,268.222.
Funkcija
[uredi | uredi izvor]Ovaj gen kodira jedan od dva alfa lanca kolagena tipa XI, manji vlaknasti kolagen. Nalazi se vrlo blizu, ali odvojeno od gena za retinoidni X receptor beta. Kolagen tipa XI je heterotrimer, ali je treći alfa lanac posttranslacijski modificirani lanac alfa 1 tip II. Proteolitska obrada lanca ovog tipa XI proizvodi PARP, protein bogat prolinom/argininom koji je amino terminalni domen. Mutacije u ovom genu povezane su s tipom III Sticklerovog sindroma, otospondilomegaepifiznom displazijom (OSMED sindrom), Weissenbacher-Zweymullerovim sindromom i autosomno dominantnom nesindromskom senzorinervnom gluhoćom 13. Za ovaj gen su identificirane tri varijante transkripta koje kodiraju različite izoforme.[7]
Klinički značaj
[uredi | uredi izvor]Pokazalo se da mutacije gena COL11A2 uzrokuju gubitak sluha bez drugih znakova ili simptoma nesindromne gluhoće, autosomno dominantnim poremećajem u dvije velike porodice. Jedna porodica nosi mutaciju koja zamjenjuje aminokiselinu cistein (građevni blok proteina) za aminokiselinu arginin na poziciji 549 (napisana kao Arg549Cys) u alfa lancu 2 kolagena tipa XI. Druga porodica ima mutaciju koja zamjenjuje aminokiselinu glutaminsku kiselinu za aminokiselinu glicin na poziciji 323 (napisana kao Gly323Glu) u ovom proteinu. Ove mutacije sprječavaju normalno sastavljanje kolagena tipa XI. Kolagen tipa XI ima važnu ulogu u strukturi i funkciji unutrašnjeg uha. Kada mutacije gena COL11A2 utiču na strukturu kolagenskih vlakana, može doći do gubitka sluha.
Otospondilomegaepifizna displazija
[uredi | uredi izvor]Otprilike 10 mutacija identificiranih u genu COL11A2 odgovorno je za otospondilomegaepifiznu displaziju (OSMED). Većina ovih mutacija rezultira potpunim nedostatkom pro-alfa2 (XI) lanaca, što dovodi do gubitka funkcije kolagena tipa XI. Neke mutacije utiču na proizvodnju lanca pro-alfa2 (XI) i remete normalno sklapanje kolagena. Budući da je ovaj tip kolagena važna komponenta hrskavice i drugog vezivnog tkiva, ove mutacije rezultiraju karakterističnim znakovima i simptomima OSMED-a.
Sticklerov sindrom
[uredi | uredi izvor]Sticklerov sindrom (COL11A2) je poremećaj koji uzrokuje probleme s razvojem skeleta, vidom i sluhom. Mutacije u genu COL11A2 uzrokuju oblik sindroma u kojem vid nije oštećen. COL11A2 mutacije uzrokuju abnormalnu proizvodnju lanca pro-alpha2 (XI), dijela kolagena tipa XI. Kao rezultat toga, kolagen tipa XI je oslabljen i ne može pravilno funkcionirati, uzrokujući probleme sa skeletom i sluhom karakteristične za Sticklerov sindrom. Lanac pro-alpha2 (XI), međutim, nije prisutan u očima. Umjesto toga, drugi tip kolagenog lanca zamjenjuje pro-alfa2 (XI), kako bi formirao kolagen tipa XI u staklastom tijelu oka. Stoga mutacije COL11A2 ne utiču na vid.
Weissenbacher-Zweymüllerov sindrom
[uredi | uredi izvor]Najmanje jedna identifikovana mutacija u genu COL11A2 odgovorna je za Weissenbacher-Zweymüllerov sindrom. Ova mutacija dovodi do zamjene aminokiseline glicin sa aminokiselinom glutaminska kiselina na položaju 955 u alfa 2 lancu kolagena tipa XI (Gly955Glu). Ova mutacija sprečava pravilno sastavljanje molekula kolagena, što narušava strukturu kolagena tipa XI. Ove promjene rezultiraju karakterističnim znakovima i simptomima Weissenbacher-Zweymüllerovog sindroma.
Vaskulitis
[uredi | uredi izvor]Pokazana je veza između ANCA-vezanog vaskulitisa i jednonukleotidnih polimorfizama (SNP-ova) u genu COL11A2, u Genomewide studiji pridruživanja. Predlaže se da ova povezanost može biti posljedica neravnoteže povezivanja između SNP-a u lokusu HLA-DP i SNP-a u COL11A2. Teoretizira se tako jer je utvrđeno da je SNP u molekuli HLA jako snažno povezan s ovim bolestima s dokazima o jednoj genetičkoj povezanosti.
Reference
[uredi | uredi izvor]- ^ a b c ENSG00000232541, ENSG00000227801, ENSG00000230930, ENSG00000206290, ENSG00000235708, ENSG00000223699 GRCh38: Ensembl release 89: ENSG00000204248, ENSG00000232541, ENSG00000227801, ENSG00000230930, ENSG00000206290, ENSG00000235708, ENSG00000223699 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000024330 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Vuristo MM, Pihlajamaa T, Vandenberg P, Prockop DJ, Ala-Kokko L (septembar 1995). "The human COL11A2 gene structure indicates that the gene has not evolved with the genes for the major fibrillar collagens". The Journal of Biological Chemistry. 270 (39): 22873–81. doi:10.1074/jbc.270.39.22873. PMID 7559422.
- ^ McGuirt WT, Prasad SD, Griffith AJ, Kunst HP, Green GE, Shpargel KB, Runge C, Huybrechts C, Mueller RF, Lynch E, King MC, Brunner HG, Cremers CW, Takanosu M, Li SW, Arita M, Mayne R, Prockop DJ, Van Camp G, Smith RJ (decembar 1999). "Mutations in COL11A2 cause non-syndromic hearing loss (DFNA13)". Nature Genetics. 23 (4): 413–9. doi:10.1038/70516. PMID 10581026. S2CID 24289573.
- ^ a b "Entrez Gene: COL11A2 collagen, type XI, alpha 2".
- ^ "UniProt, P13942" (jezik: engleski). Pristupljeno 1. 10. 2021.
Dopunska literatura
[uredi | uredi izvor]- Kuivaniemi H, Tromp G, Prockop DJ (1997). "Mutations in fibrillar collagens (types I, II, III, and XI), fibril-associated collagen (type IX), and network-forming collagen (type X) cause a spectrum of diseases of bone, cartilage, and blood vessels". Human Mutation. 9 (4): 300–15. doi:10.1002/(SICI)1098-1004(1997)9:4<300::AID-HUMU2>3.0.CO;2-9. PMID 9101290.
- Van Camp G, Willems PJ, Smith RJ (april 1997). "Nonsyndromic hearing impairment: unparalleled heterogeneity". American Journal of Human Genetics. 60 (4): 758–64. PMC 1712474. PMID 9106521.
- Hanson IM, Gorman P, Lui VC, Cheah KS, Solomon E, Trowsdale J (novembar 1989). "The human alpha 2(XI) collagen gene (COL11A2) maps to the centromeric border of the major histocompatibility complex on chromosome 6". Genomics. 5 (4): 925–31. doi:10.1016/0888-7543(89)90135-3. PMID 2591970.
- Kimura T, Cheah KS, Chan SD, Lui VC, Mattei MG, van der Rest M, Ono K, Solomon E, Ninomiya Y, Olsen BR (august 1989). "The human alpha 2(XI) collagen (COL11A2) chain. Molecular cloning of cDNA and genomic DNA reveals characteristics of a fibrillar collagen with differences in genomic organization". The Journal of Biological Chemistry. 264 (23): 13910–6. PMID 2760050.
- Keene DR, Oxford JT, Morris NP (oktobar 1995). "Ultrastructural localization of collagen types II, IX, and XI in the growth plate of human rib and fetal bovine epiphyseal cartilage: type XI collagen is restricted to thin fibrils". The Journal of Histochemistry and Cytochemistry. 43 (10): 967–79. doi:10.1177/43.10.7560887. PMID 7560887.
- Zhidkova NI, Justice SK, Mayne R (april 1995). "Alternative mRNA processing occurs in the variable region of the pro-alpha 1(XI) and pro-alpha 2(XI) collagen chains". The Journal of Biological Chemistry. 270 (16): 9486–93. doi:10.1074/jbc.270.16.9486. PMID 7721876.
- Tsumaki N, Kimura T (februar 1995). "Differential expression of an acidic domain in the amino-terminal propeptide of mouse pro-alpha 2(XI) collagen by complex alternative splicing". The Journal of Biological Chemistry. 270 (5): 2372–8. doi:10.1074/jbc.270.5.2372. PMID 7836472.
- Vikkula M, Mariman EC, Lui VC, Zhidkova NI, Tiller GE, Goldring MB, van Beersum SE, de Waal Malefijt MC, van den Hoogen FH, Ropers HH (februar 1995). "Autosomal dominant and recessive osteochondrodysplasias associated with the COL11A2 locus". Cell. 80 (3): 431–7. doi:10.1016/0092-8674(95)90493-X. hdl:2066/21466. PMID 7859284. S2CID 5681665.
- Zhidkova NI, Brewton RG, Mayne R (juli 1993). "Molecular cloning of PARP (proline/arginine-rich protein) from human cartilage and subsequent demonstration that PARP is a fragment of the NH2-terminal domain of the collagen alpha 2(XI) chain". FEBS Letters. 326 (1–3): 25–8. doi:10.1016/0014-5793(93)81753-M. PMID 8325374. S2CID 40459191.
- Lui VC, Ng LJ, Sat EW, Nicholls J, Cheah KS (juli 1996). "Extensive alternative splicing within the amino-propeptide coding domain of alpha2(XI) procollagen mRNAs. Expression of transcripts encoding truncated pro-alpha chains" (PDF). The Journal of Biological Chemistry. 271 (28): 16945–51. doi:10.1074/jbc.271.28.16945. PMID 8663204. S2CID 54963003.
- Lui VC, Ng LJ, Sat EW, Cheah KS (mart 1996). "The human alpha 2(XI) collagen gene (COL11A2): completion of coding information, identification of the promoter sequence, and precise localization within the major histocompatibility complex reveal overlap with the KE5 gene". Genomics. 32 (3): 401–12. doi:10.1006/geno.1996.0135. PMID 8838804.
- van Steensel MA, Buma P, de Waal Malefijt MC, van den Hoogen FH, Brunner HG (juni 1997). "Oto- spondylo-megaepiphyseal dysplasia (OSMED): clinical description of three patients homozygous for a missense mutation in the COL11A2 gene" (PDF). American Journal of Medical Genetics. 70 (3): 315–23. doi:10.1002/(SICI)1096-8628(19970613)70:3<315::AID-AJMG19>3.0.CO;2-O. hdl:2066/24596. PMID 9188673.
- Sirko-Osadsa DA, Murray MA, Scott JA, Lavery MA, Warman ML, Robin NH (februar 1998). "Stickler syndrome without eye involvement is caused by mutations in COL11A2, the gene encoding the alpha2(XI) chain of type XI collagen". The Journal of Pediatrics. 132 (2): 368–71. doi:10.1016/S0022-3476(98)70466-4. PMID 9506662.
- Koga H, Sakou T, Taketomi E, Hayashi K, Numasawa T, Harata S, Yone K, Matsunaga S, Otterud B, Inoue I, Leppert M (juni 1998). "Genetic mapping of ossification of the posterior longitudinal ligament of the spine". American Journal of Human Genetics. 62 (6): 1460–7. doi:10.1086/301868. PMC 1377147. PMID 9585596.
- Pihlajamaa T, Prockop DJ, Faber J, Winterpacht A, Zabel B, Giedion A, Wiesbauer P, Spranger J, Ala-Kokko L (novembar 1998). "Heterozygous glycine substitution in the COL11A2 gene in the original patient with the Weissenbacher-Zweymüller syndrome demonstrates its identity with heterozygous OSMED (nonocular Stickler syndrome)". American Journal of Medical Genetics. 80 (2): 115–20. doi:10.1002/(SICI)1096-8628(19981102)80:2<115::AID-AJMG5>3.0.CO;2-O. PMID 9805126.
- Melkoniemi M, Brunner HG, Manouvrier S, Hennekam R, Superti-Furga A, Kääriäinen H, Pauli RM, van Essen T, Warman ML, Bonaventure J, Miny P, Ala-Kokko L (februar 2000). "Autosomal recessive disorder otospondylomegaepiphyseal dysplasia is associated with loss-of-function mutations in the COL11A2 gene". American Journal of Human Genetics. 66 (2): 368–77. doi:10.1086/302750. PMC 1288089. PMID 10677296.