Zika-Virus
| Zika-Virus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Elektronenmikroskopische Aufnahme von Zika-Virus-Partikeln | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Zika virus | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| ZIKV | ||||||||||||||||||
| Links | ||||||||||||||||||
|
| Klassifikation nach ICD-10 | |
|---|---|
| A92.5 | Zika-Viruskrankheit |
| P35.4 | Angeborene Zika-Viruskrankheit
(Mikrozephalie durch kongenitale Zika-Viruskrankheit) |
| ICD-10 online (WHO-Version 2019) | |
Als Zika-Virus () (ZIKV) werden verschiedene Isolate der Spezies Orthoflavivirus zikaense der Familie Flaviviridae bezeichnet.[3] Das Virus kommt endemisch in Afrika und Südostasien vor, die verschiedenen Virusstämme werden deshalb in eine afrikanische und eine asiatische Gruppe unterteilt.[4][5] Infektionen mit dem Zika-Virus rufen in einem von 5 Infizierten „Zikafieber“ hervor (Hautausschlag und Fieber, Gelenkschmerzen, Konjunktivitis sowie seltener Muskel- und Kopfschmerzen und Erbrechen). Da seit 2015 erstmals und zugleich gehäuft Schädigungen von Föten bei Schwangeren in Lateinamerika beobachtet wurden, erklärte die Weltgesundheitsorganisation (WHO) am 1. Februar 2016 den „Öffentlichen Gesundheitsnotstand internationalen Ausmaßes“.[6]
Isolate
[Bearbeiten | Quelltext bearbeiten]Isolate des Zikavirus nach ICTV (I) und NCBI (N):[3][7]
Spezies: Orthoflavivirus zikaense
- Zikavirus (englisch Zika virus, ZIKV)
- MR 766 (I) mit Schreibvariante
MR766 (N)
– Genomlänge: 10.727, 10.794 oder 10.807 nt[8] - Pf13/251013-18 (I,N)
– Genomlänge: 11.155, 10.769 oder 10.807 nt[9] - H/PF/2013 (I,N)[10] alias
ZIKV/H. sapiens/FrenchPolynesia/10087PF/2013 (N)[11]
– Genomlänge: 10.807 nt[10] - PRVABC59 (I,N)
– Genomlänge: 10.644, 10.658, 10.675, 10.778 oder 10.807 nt[12] - FSS13025 alias
ZIKV/Human/Cambodia/FSS13025/2010 (N)
– Genomlänge: 10.766 oder 10.807 nt[13]
- MR 766 (I) mit Schreibvariante
Aufbau
[Bearbeiten | Quelltext bearbeiten]
Genom
[Bearbeiten | Quelltext bearbeiten]Der prinzipielle Aufbau und die möglichen Virusproteine des Zika-Virus unterscheiden sich nicht wesentlich von anderen Vertretern der Gattung Flavivirus. Am nächsten ist das Zika-Virus mit dem (noch nicht offiziell bestätigten) ‚Spondweni-Virus‘ verwandt, mit dem es eine Klade innerhalb der Moskito-übertragenen Flaviviren bildet.[14][15][16] Das Virusgenom besteht aus einer 10.794 Basen langen Einzelstrang-RNA positiver Polarität, die einen etwa 10.300 Basen langen offenen Leserahmen enthält, der für die Virusproteine kodiert und am 5′- und am 3′-Ende von nicht-kodierenden Sequenzen flankiert ist. Das 5′-Ende besitzt eine Cap-Struktur und das 3′-Ende keinen Poly-A-Schwanz, sondern bildet eine schleifenförmige Sekundärstruktur aus. Diese Schleife wird von der zellulären RNase XRN1 erkannt und vom Genom abgespalten.[17] Das dabei freigesetzte 3'-Ende (subgenomic flavivirus RNA, sfRNA) ist als Virulenzfaktor an der Pathogenität der Flaviviren beteiligt, vermutlich durch die Hemmung des zellulären Resistenzfaktors RIG-I.[17] Die erste vollständige Sequenz des Virusgenoms eines Isolates wurde im Jahr 2006 publiziert.[18] Aus dem RNA-Genom wird im Zuge der Proteinbiosynthese ein Polyprotein von etwa 3417 bis 3423 Aminosäuren gebildet, das anschließend durch virale und zelluläre Proteasen in die einzelnen viralen Proteine gespalten wird.
Das Zika-Virus (und einige Verwandte) kann den Abbau der RNA verhindern, indem es dieser auf spezielle Weise „verknotet“, wodurch eine Exoribonuklease-resistente RNA (en. exoribonuclease-resistant RNA, xrRNA) entsteht.[19][20]
Nahe Verwandte des Zika-Virus sind die Flaviviren Dengue-Virus und West-Nil-Virus, die ebenfalls von Aedes-Mücken übertragen werden und als emerging pathogens eingestuft wurden, beim Menschen jedoch weitaus schwerere Erkrankungen hervorrufen können. Ein weiterer Verwandter ist das Gelbfieber-Virus, das durch die Gelbfiebermücke (Stegomyia aegypti, früher Aedes aegypti) übertragen wird. Auch diese Flaviviren bilden xrRNA.[21]
Virusproteine
[Bearbeiten | Quelltext bearbeiten]Nach vollständiger Sequenzierung des Virusgenoms eines Isolats aus Französisch-Polynesien aus dem Jahr 2013 wurden folgende mögliche Virusproteine aus der Nukleotidsequenz abgeleitet:[22]
- wahrscheinlich drei Strukturproteine: ein Kapsidprotein C (105 Aminosäuren), ein Prä-Membran/Membranprotein M (187 Aminosäuren) und das Hüllprotein E (505 Aminosäuren)
- sieben Nichtstrukturproteine: NS1 (352 Aminosäuren), NS2A (217 Aminosäuren), NS2B (139 Aminosäuren), NS3 (Protease, 619 Aminosäuren), NS4A (127 Aminosäuren), NS4B (255 Aminosäuren), NS5 (RNA-Polymerase, 904 Aminosäuren).
Virion
[Bearbeiten | Quelltext bearbeiten]
Das Virion besitzt einen Durchmesser von circa 50 Nanometer und eine ikosaedrische Form der Virushülle und des Kapsids, mit je drei Homodimeren des E-Proteins (Rezeptor, Transmembranprotein und fusogenes Protein) auf jeder Fläche der Außenseite.[17] Das E-Protein besitzt eine Serinprotease-Aktivität. Teilweise verdeckt vom E-Protein liegt das andere Transmembranprotein M in der Virushülle.[17] Unter der Virushülle liegt das Kapsid aus dem Kapsidprotein C, das die virale RNA ummantelt.[17]
Replikationszyklus
[Bearbeiten | Quelltext bearbeiten]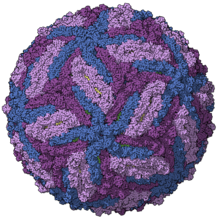
Nach der Bindung des viralen Rezeptors E-Protein an ein bisher unbekanntes zelluläres Oberflächenprotein erfolgt die Einstülpung des Virions per Endozytose in ein Endosom. Im Endosom sorgt das E-Protein als fusogenes Protein für die Verschmelzung von Virushülle und Endosomenmembran, wodurch das Kapsid ins Zytosol freigesetzt wird. Dort erfolgt die Entpackung des Kapsids und des RNA-Genoms. Die Replikation des Genoms erfolgt im Zytosol durch die RNA-Polymerase NS5, bei der doppelsträngige virale RNA gebildet wird. Da das RNA-Genom eine positive Polarität aufweist, wird aus den kopierten RNA-Genomen und gleichzeitig aus dem entpackten RNA-Strang per Proteinbiosynthese direkt (ohne Replikation) das virale Polyprotein erzeugt, welches anschließend durch Proteolyse in die einzelnen viralen Proteine gespalten wird. Der Zusammenbau eines neugebildeten Virions findet im endoplasmatischen Retikulum statt. Nach einem Transfer in den Golgi-Apparat erfolgt die Reifung des Virions durch eine Proteolyse des Proteins prM. Zika-Viren sind nichtlytische Viren und verlassen die Wirtszelle durch Exozytose.
Der Tropismus des Zika-Virus umfasst unter anderem Zellen der Haut und neuronale Stammzellen.[23][24] Aufgrund der Infektion neuronaler embryonaler Stammzellen entstehen vermutlich die Schäden bei der neuronalen Entwicklung von Embryonen.[24] Das Zika-Virus führt in Mäuse-Föten zu neuronalen Infektionen und in Folge zu neuronalen Defekten.[25][26]
Infektion beim Menschen
[Bearbeiten | Quelltext bearbeiten]Das Zika-Virus ist beim Menschen Verursacher des Zikafiebers.
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]
bestätigte, in der Region erworbene Infektionen
Infektionen bisher nur serologisch nachgewiesen
Es wurde erstmals 1947 aus einem gezielt zum Auffinden des Gelbfiebervirus gefangen gehaltenen Rhesusaffen (einem sogenannten Markertier oder sentinel monkey) einer Forschungsstation im Zika Forest in Entebbe, Uganda, isoliert und nach dem Ort benannt.[27][28] Erstmals im Menschen nachgewiesen wurde das Zika-Virus im Jahr 1952 in Uganda und Tansania.[29][30] In den folgenden Jahrzehnten breitete sich das Virus in Afrika und Asien weiträumig aus.[4][31] Bis 2007 waren jedoch weniger als 15 Infektionen beim Menschen bekannt, die alle in Afrika oder Südostasien nachgewiesen wurden.[32]
Der erste große Ausbruch beim Menschen – auf den Yap-Inseln Mikronesiens im Jahr 2007 – hat dazu geführt, dass das Zika-Virus als sogenanntes Emergent Virus eingestuft wurde, das heißt als Krankheitserreger, der sich möglicherweise noch weiter über die Welt ausbreiten könne.[33] Nachfolgend kam es 2013-2014 zu einer Epidemie in Französisch-Polynesien, bei der erstmals ein vermehrtes Vorkommen des Guillain-Barré-Syndroms (GBS) beobachtet wurde, sowie eine Übertragung auf das ungeborene Kind belegt werden konnte.
Ab 2015 wurden dann zunehmend mehr Fälle von Zika-Fieber in Süd-, Mittelamerika und der Karibik beobachtet, die alle durch die asiatische Linie des Zikavirus ausgelöst wurden. Phylogenetisch wird vermutet, dass das Virus bereits 2013 in Amerika angekommen ist. Ab 2015 wurden wieder Ausbrüche zurück in Afrika (Kap Verde, Guinea-Bissau und Angola) beschrieben, die ebenfalls durch die asiatische Linie ausgelöst wurden.
Der Ausbruch in Lateinamerika 2015 wird als „perfekter Sturm“ beschrieben, weil eine neue Linie, die amerikanische Subklade, auf eine komplett empfängliche (suszeptible) Bevölkerung traf und 60 % der exponierten Bevölkerung infizierte.[34]
Erste endemische Zika-Virus-Übertragungen durch Stechmücken in Europa wurden im Herbst 2019 aus Südfrankreich berichtet.[35]
Übertragung
[Bearbeiten | Quelltext bearbeiten]Das natürliche Vorkommen der Zika-Viren liegt im tropischen Afrika; Infektionsfälle gibt es aber in der gesamten tropischen Klimazone. Reisende haben das Virus gelegentlich auch in andere Klimazonen, beispielsweise nach Europa, verschleppt.
Die Biologie und die Übertragungswege des Zika-Virus waren bis Ende 2015 wenig erforscht.[32] Bekannt war jedoch, dass die Viren wohl vor allem durch Stechmücken der Art Aedes aegypti[36] sowie durch andere Arten der Gattung Aedes, darunter möglicherweise auch die Asiatische Tigermücke (Aedes albopictus)[37][38][39] übertragen werden. In mehreren Laborexperimenten wurde seit 2016 nachgewiesen, dass auch Aedes albopictus – jedoch erst bei Temperaturen über 27 Grad – die Viren übertragen kann.[40] Ob und in welchem Umfang Stechmücken der Art Culex Zika-Viren übertragen, wird aktuell (2019) untersucht. Am besten erforscht ist die Vektorkompetenz von Cx. quinquefasciatus. Noch nie wurde ZIKV-RNA in Stechmücken dieser Art im Rahmen einer Felduntersuchung nachgewiesen. Die Fähigkeit zur Übertragung im Labor wird durch eine überwiegende Anzahl von Studien widerlegt[41]. Es gibt auch Ergebnisse von Experimenten, die dafür sprechen[42][43][44]. Dass in Mitteleuropa endemische Culex-Arten an der Übertragung von Zika-Viren beteiligt sind, kann aktuell jedoch recht sicher ausgeschlossen werden. Am umfassendsten konnte das Fehlen einer relevanten experimentellen Vektorkompetenz für Zika für die drei in Mitteleuropa häufigsten Arten Cx. p. pipiens, Cx. p. molestus und Cx. torrentium gezeigt werden.[45][40]
Auch eine Übertragung über sexuellen Kontakt zwischen Menschen ist möglich, wenngleich bislang lediglich Einzelfälle bekannt sind. Bereits aus dem Jahr 2009 ist ein Fall dokumentiert, in dem ein Biologe der Colorado State University seine Frau mit dem Virus angesteckt haben soll.[46][47] Anfang Februar 2016 gab es erneut Berichte, wonach in Dallas eine sexuelle Übertragung zwischen Menschen nachgewiesen wurde.[48][49] Im Oktober 2016 wurde in einer Fachzeitschrift publiziert, dass das vollständige Virusgenom aus Samenflüssigkeit isoliert wurde.[50] Einer 2019 veröffentlichten Studie zufolge waren die Viren in Spermaproben bei 8 von 97 untersuchten Patienten mit anfangs hoher Viruslast noch bis zu 38 Tage nach der ersten Diagnose nachweisbar.[51]
Auch im Urin und Speichel von symptomatischen Patienten wurde genetisches Material von Zikaviren nachgewiesen. Inwiefern die Zikaviren auch durch Urin und Speichel übertragen werden können, ist noch nicht bekannt.
Infektionsverlauf
[Bearbeiten | Quelltext bearbeiten]
Die bekannt gewordenen Infektionsverläufe waren zunächst relativ milde, und nur eine von fünf infizierten Personen entwickelt Symptome: insbesondere Hautausschlag und Fieber („Zikafieber“), Gelenkschmerzen, Konjunktivitis sowie seltener Muskel- und Kopfschmerzen und Erbrechen. Die Symptome klingen in der Regel bereits nach wenigen Tagen, spätestens nach einer Woche, ab.[52] Es gibt bislang keine gesicherten Todesfälle. Allerdings gibt es Verdachtsfälle in Kolumbien, bei denen bei drei Patienten nach einer Zika-Infektion das Guillain-Barré-Syndrom aufgetreten sei und dies zum Tod der Erkrankten geführt hätte.[53] In einer Studie mit Patienten aus Französisch-Polynesien wurde eine Häufung von Guillain-Barré-Syndromen bei serologischem Nachweis einer früheren oder kürzlichen Infektion mit dem Zika-Virus festgestellt. In den untersuchten Serumproben von 42 Patienten mit einem Guillain-Barré-Syndrom konnten spezifische Antikörper gegen das Zika-Virus nachgewiesen werden, bei einigen Patienten zusätzlich Antikörper gegen weitere tropische Arboviren. Keiner dieser Patienten mit GBS ist an diesem verstorben.[54]
Infektionen in der Schwangerschaft
[Bearbeiten | Quelltext bearbeiten]
Aufgrund der epidemiologischen Daten gab es seit Ende 2015 den dringenden Verdacht auf einen Zusammenhang zwischen Infektionen mit dem Zika-Virus bei Schwangeren während des ersten Drittels der Schwangerschaft[55] und Mikrozephalien bei Föten[56][57] beziehungsweise bei Neugeborenen.[58][59]
Anfang 2016 wurde der erste sichere virologische Nachweis für eine Infektion des fötalen Gehirns mit dem Zika-Virus bei bestehender Mikrozephalie erbracht:[60]
Eine Frau, die sich in Natal (Brasilien) aufhielt, wurde dort schwanger und erkrankte in der 13. Schwangerschaftswoche (SSW) mit allen klinischen Zeichen des Zika-Fiebers. Die Ultraschall-Untersuchung zeigte beim Fötus in der 14. und 20. SSW keine morphologischen Auffälligkeiten. Zurück in Ljubljana fanden sich in der 29. SSW erste Anzeichen einer Mikrozephalie beim Fötus, in der 32. SSW schließlich eine schwergradige Mikrozephalie (Hirngröße unterhalb der 2. Perzentile), intrazerebrale Verkalkungen, eine Vergrößerung der Hirnventrikel und eine schwere generelle Wachstumsstörung (Gewicht des Fötus unterhalb der 3. Perzentile). Auch in der Plazenta fielen Verkalkungen auf. Nach dem Schwangerschaftsabbruch fand man im Hirngewebe des Fötus virale RNA des Zika-Virus. Dessen gesamtes Genom wurde sequenziert. Das Virusisolat stimmte auf RNA-Ebene zu 99,7 Prozent mit einem Isolat aus Französisch-Polynesien überein, das im Jahr 2013 sequenziert wurde. In anderen Organen (Plazenta, Herz, Lunge, Haut, Thymus, Milz, Leber und Nieren) wurde kein Zika-Virus nachgewiesen. Bei einer elektronenmikroskopischen Untersuchung des Hirngewebes zeigten sich Flavivirus-ähnliche Partikel.
Die Schädigung des fötalen Gehirns beginnt ab der 20. SSW mit einer Störung der Hirnrinden-Reifung und der Verzögerung der gyralen Faltung. Ungewöhnlich ist auch der Umstand, dass das Virus 21 Wochen beim Fötus persistierte und die nach der mütterlichen Infektion gebildeten IgG-Antikörper nach Ausheilung der akuten Infektion nicht in der Lage waren, die Infektion beim Fötus ebenfalls zu beenden.
Die Ergebnisse untermauern den vorherigen Nachweis von Zika-Virus-RNA im Fruchtwasser bei zwei mikrozephalen Föten in Brasilien in der 29. bzw. 30. SSW.[61] Auch bei diesen zwei Fällen entsprach die virale RNA den asiatischen Zika-Virus-Isolaten. Die US-Gesundheitsbehörde CDC kam im April 2016 nach Auswertung diverser Studien zu dem Schluss, dass Zika-Viren eindeutig die Schädelfehlbildung Mikrozephalie bei Föten verursachen.[62][63][64][65] Im Dezember 2016 wurde in einer ersten, größeren Verlaufstudie an Schwangeren Belege dafür gefunden, dass infolge einer Zika-Virus-Infektion das Risiko für Fehlbildungen und andere Schädigungen im Vergleich mit einer Kontrollgruppe sehr erheblich erhöht wird.[66]
Nach bisherigen Erkenntnissen verläuft das Zika-Fieber für Schwangere selbst nicht schwerer, länger oder mit einer erhöhten Häufigkeit von Komplikationen als bei Nicht-Schwangeren.
Die Studie 'Cross-Protection of Dengue Virus Infection against Congenital Zika Syndrome, Northeastern Brazil' stellt die Hypothese auf, dass eine vorherige Dengue-Infektion bei der Mutter möglicherweise schützend gegen die Entwicklung des kongenitalen Zika-Syndroms beim Fötus wirken könnte.[67]
Diagnose
[Bearbeiten | Quelltext bearbeiten]Die Diagnose von Zika-Virus-Infektionen aufgrund der klinischen Symptomatik ist schwierig, da es andere in den entsprechenden Regionen endemische Arboviren gibt, die sehr ähnliche unspezifische klinische Symptome hervorrufen.[68] In akut erkrankten Patienten konnte das Zika-Virus per RT-PCR nachgewiesen werden. Die virämische Phase, in der dieser Nachweis aus dem Blut gelingt, kann mit nur wenigen Tagen allerdings kurz sein.[69] Aus diesem Grund empfiehlt die Weltgesundheitsorganisation die Durchführung von RT-PCR-Tests mit Serumproben innerhalb von ein bis drei Tagen nach Auftreten der ersten Symptome, und zusätzlich innerhalb von drei bis fünf Tagen nach Auftreten der ersten Symptome in Speichel- oder Urinproben.[70] Serologische Tests zum Nachweis von spezifischen IgM- und IgG-Antikörpern wurden ebenfalls verwendet, obwohl ihr Aussagewert bezüglich Spezifität und Sensitivität eingeschränkt ist. IgM kann meist innerhalb von drei Tagen nach Krankheitsbeginn nachgewiesen werden.[71] Die Antikörpernachweise, insbesondere der IgM-Nachweis, können falsch positive Ergebnisse erbringen, da eine serologische Kreuzreaktivität mit engverwandten (d. h. aus derselben Gattung stammenden) Flaviviren wie dem Dengue-Virus und West-Nil-Virus oder nach Impfungen gegen Flaviviren (Gelbfiebervirus, FSME-Virus) möglich sind.[69][72][73]
Die Centers for Disease Control and Prevention (CDC) in den USA weisen darauf hin, dass die Differentialdiagnostik von Zika-Infektionen, basierend auf den typischen klinischen Zeichen, sehr breit gefächert ist und dass eine Vielzahl anderer viraler, aber auch bakterieller Infektionen abzugrenzen sind. Speziell in Lateinamerika ist das häufige Denguevirus auszuschließen, das bei akuter Infektion ähnliche Allgemeinsymptome und ein ähnliches Exanthem hervorrufen kann. Als virale Ursachen kommen noch weltweit verbreitete Infektionen mit Rötelnvirus, Masernvirus und Parvovirus B19 (alle mit einem möglichen Exanthem) sowie nicht-exanthematische Infektionen mit Enteroviren, Adenoviren und verschiedenen Alphaviren (z. B. Chikungunya-Virus, Mayaro-Virus, Ross-River-Virus, Barmah-Forest-Virus, O’nyong-nyong-Virus und Sindbis-Virus) differentialdiagnostisch in Frage. Als bakterielle Infektionskrankheiten sind eine Leptospirose, Rickettsiose und Infektionen mit A-Streptokokken abzugrenzen, die jedoch ähnlich wie eine in den Tropen stets auszuschließende Malaria zusätzlich charakteristische Symptome aufweisen.[74][75]
Nach Angaben der Gesellschaft für Virologie vom April 2016 ermöglicht ein ZIKV NS1[76]-Antigen-basierter Test nunmehr nach wenigen Stunden die eindeutige Diagnose einer durchgemachten Zika-Virus-Infektion.[77] Forscher konnten nachweisen, dass der Test zum Nachweis von ZIKV-Antikörpern auch dann hochspezifisch ist, wenn bei dem zu Untersuchenden eine früher erfolgte und laborgesicherte FSME-Infektion oder -Impfung vorliegt.[78]
Schutz
[Bearbeiten | Quelltext bearbeiten]Es existieren bislang weder eine Impfung noch Medikamente zur Krankheitsprävention. Bis möglicherweise ein Impfstoff verfügbar ist, könnten nach Einschätzung vieler Wissenschaftler Jahre vergehen.[79] Erste potentielle Impfstoffe werden seit Juli 2016 in Phase-I-Studien getestet, erste Ergebnisse werden jedoch nicht vor Ende 2017 vorliegen.[80] Als Schutzmaßnahmen gelten daher lediglich ein allgemeiner Schutz gegen Moskitostiche oder gar das Meiden entsprechender Klimazonen.[81] Aufgrund von Berichten über eine sexuelle Übertragung der Viren gelten die allgemeinen Schutzmaßnahmen vor sexuell übertragbaren Krankheiten, wie insbesondere der Gebrauch von Kondomen.
Es ist bislang nicht bekannt, ob eine einmal durchgemachte Infektion zumindest zu einer zeitlich begrenzten Immunität führt.[82]
Meldepflicht
[Bearbeiten | Quelltext bearbeiten]In Deutschland ist der direkte oder indirekte Nachweis des Zika-Virus namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes (IfSG), soweit der Nachweis auf eine akute Infektion hinweist. Meldepflichtig sind die Leitungen der Labore usw. (§ 8 IfSG).
In Österreich sind Zika-Virus-Infektionen anzeigepflichtige Krankheiten gemäß § 1 Abs. 1 Nr. 2 Epidemiegesetz 1950. Meldepflichtig sind Erkrankungs- und Todesfälle. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz 1950).
In der Schweiz ist der positive Befund zum Zika-Virus meldepflichtig durch das untersuchende Laboratorium und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Zudem ist Zika-Fieber bei positivem laboranalytischen Befund für Ärztinnen und Ärzte, Spitäler und andere öffentliche und private Institutionen des Gesundheitswesens eine meldepflichtige Krankheit nach den genannten Normen und Anhang 1 der genannten Verordnung des EDI.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Robert Koch-Institut: Zikavirus-Infektionen. Auf: rki.de Stand 14. Juli 2022; zuletzt abgerufen am 22. Februar 2023.
- Deutsches Auswärtiges Amt: Merkblatt für Beschäftigte und Reisende. (PDF) Auf: auswaertiges-amt.de vom 25. Januar 2016.
- Deutsches Auswärtiges Amt: Verhütung von Infektionskrankheiten durch Schutz vor Insektenstichen (Expositionsprophylaxe). (PDF; 0,3 MB) Auf: auswaertiges-amt.de Stand: 03/2019; zuletzt abgerufen am 22. Februar 2023.
- Zika Virus in South America. Hinweise für Reisende, speziell für Schwangere, auf den Webseiten der US-Gesundheitsbehörde CDC (englisch) Auf: cdc.gov 24. Mai 2022; zuletzt abgerufen am 22. Februar 2023.
- Weltgesundheitsorganisation: Health topics: Zika virus. Auf: who.int; zuletzt abgerufen am 22. Februar 2023.
- OpenZika Project: February 2023 OpenZika Project Update − Brief history of the OpenZika project. Ergebnisse des OpenZika Projekts Auf: worldcommunitygrid.org vom 9. Februar 2023; zuletzt abgerufen am 22. Februar 2023.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d ICTV Taxonomy history: Yellow fever virus. ICTV; EC 51, Berlin (Germany) Juli 2019; Email ratification March 2020 (MSL #35).
- ↑ ICTV Master Species List 2018b.v2. MSL #34, März 2019.
- ↑ a b ICTV: Virus Metadata Resource (VMR).
- ↑ a b Andrew D. Haddow, Amy J. Schuh, Chadwick Y. Yasuda u. a.: Genetic Characterization of Zika Virus Strains: Geographic Expansion of the Asian Lineage. In: PLoS Neglected Tropical Diseases. Band 6, Nr. 2, Februar 2012, Artikel e1477, doi:10.1371/journal.pntd.0001477.
- ↑ Antoine Enfissi, John Codrington, Jimmy Roosblad et al.: Zika virus genome from the Americas. In: The Lancet. Band 387, Nr. 10015, 16. Januar 2016, S. 227–228, doi:10.1016/S0140-6736(16)00003-9.
- ↑ WHO statement on the first meeting of the International Health Regulations (2005) (IHR 2005) Emergency Committee on Zika virus and observed increase in neurological disorders and neonatal malformations. 1. Februar 2016, abgerufen am 1. Februar 2016 (englisch).
- ↑ NCBI Taxonomy Browser: Orthoflavivirus zikaense.
- ↑ NCBI Taxonomy Browser: Zika virus (no rank), Nucleotide: txid64320[Organism:exp] and (Zika virus[Title]) and (MR766 or (MR 766[Strain]).
- ↑ NCBI Nucleotide: txid64320[Organism:exp] and 251013-18.
- ↑ a b NCBI Nucleotide: (H/PF/2013[Isolate]) OR (H/PF/2013[Strain]).
- ↑ NCBI Taxonomy Browser: Zika virus ZIKV/H. sapiens/FrenchPolynesia/10087PF/2013 (no rank).
- ↑ NCBI Nucleotide: txid64320[Organism:exp] and PRVABC59.
- ↑ NCBI Taxonomy Browser: Zika virus ZIKV/Human/Cambodia/FSS13025/2010 (no rank), Nucleotide: txid64320[Organism:exp] and FSS13025.
- ↑ R. S. Lanciotti, O. L. Kosoy, J. J. Laven et al.: Genetic and serologic properties of Zika virus associated with an epidemic, Yap State, Micronesia, 2007. In: Emerging infectious diseases. Band 14, Nummer 8, August 2008, S. 1232–1239, doi:10.3201/eid1408.080287, PMID 18680646, PMC 2600394 (freier Volltext).
- ↑ G. Kuno, G. J. Chang, K. R. Tsuchiya, N. Karabatsos, C. B. Cropp: Phylogeny of the genus Flavivirus. In: Journal of virology. Band 72, Nr. 1, Januar 1998, S. 73–83, PMID 9420202, PMC 109351 (freier Volltext).
- ↑ S. Cook, E. C. Holmes: A multigene analysis of the phylogenetic relationships among the flaviviruses (Family: Flaviviridae) and the evolution of vector transmission. In: Archives of virology. Band 151, Nr. 2, Februar 2006, S. 309–325, doi:10.1007/s00705-005-0626-6, PMID 16172840.
- ↑ a b c d e Zika-Virus. ExPASy / ViralZone; abgerufen am 3. Februar 2016.
- ↑ G. Kuno, G. J. Chang: Full-length sequencing and genomic characterization of Bagaza, Kedougou, and Zika viruses. In: Archives of Virology. 2007, Band 152, S. 687–696, doi:10.1007/s00705-006-0903-z, PMID 17195954.
- ↑ Antonio Suma, Lucia Coronel, Giovanni Bussi, Cristian Micheletti: Directional translocation resistance of Zika xrRNA. In: Nature Communications. Band 11, Nr. 3749, 27. Juli 2020, doi:10.1038/s41467-020-17508-7.
- ↑ Meng Zhao, Michael T. Woodside: Mechanical strength of RNA knot in Zika virus protects against cellular defenses. In: Nature Chemical Biology. 12. Juli 2021, doi:10.1038/s41589-021-00829-z / Dazu: Meng Zhao, Michael Woodside: Mechanical strength of RNA knot in Zika virus protects against cellular defenses: optical tweezers data. Auf: figshare.com vom 29. Juni 2021 / Jan Osterkamp: Biologisches Wettrüsten: Knoten in RNA macht Viren gefährlicher. Auf: Spektrum.de vom 12. Juli 2021.
- ↑ Andrea MacFadden, Zoe O’Donoghue, Patricia A. G. C. Silva, Erich G. Chapman, René C. Olsthoorn, Mark G. Sterken, Gorben P. Pijlman, Peter J. Bredenbeek, Jeffrey S. Kieftcorresponding: Mechanism and structural diversity of exoribonuclease-resistant RNA structures in flaviviral RNAs. In: Nature Communications. Band 9, Nr. 119, Epub 9. Januar 2018, doi:10.1038/s41467-017-02604-y, PMC 5760640 (freier Volltext), PMID 29317714.
- ↑ C. Barontia, G. Piorkowskia, R. N. Charrela u. a.: Complete Coding Sequence of Zika Virus from a French Polynesia Outbreak in 2013. In: Genome Announcements. 2014, Band 2, Nr. 3, Artikel e00500-14, doi:10.1128/genomeA.00500-14.
- ↑ R. Hamel, O. Dejarnac, S. Wichit et al.: Biology of Zika Virus Infection in Human Skin Cells. In: Journal of virology. Band 89, Nr. 17, September 2015, S. 8880–8896, doi:10.1128/JVI.00354-15, PMID 26085147, PMC 4524089 (freier Volltext).
- ↑ a b Hengli Tang, Christy Hammack, Sarah C. Ogden et al.: Zika Virus Infects Human Cortical Neural Progenitors and Attenuates Their Growth. In: Cell Stem Cell. Band 18, Nr. 5, 2016, doi:10.1016/j.stem.2016.02.016.
- ↑ Fernanda R. Cugola, Isabella R. Fernandes, Fabiele B. Russo et al.: The Brazilian Zika virus strain causes birth defects in experimental models. In: Nature. 2016, doi:10.1038/nature18296.
- ↑ Jonathan J. Miner, Bin Cao, Jennifer Govero et al.: Zika Virus Infection during Pregnancy in Mice Causes Placental Damage and Fetal Demise. In: Cell. Band 165, Nr. 5, 2016, doi:10.1016/j.cell.2016.05.008.
- ↑ G. W. Dick et al.: Zika virus. I. Isolations and serological specificity. In: Transactions of the Royal Society of Tropical Medicine and Hygiene. Band 46, Nr. 5, 1952, S. 509–520, PMID 12995440, doi:10.1016/0035-9203(52)90042-4.
- ↑ D. I. H. Simpson: Zika virus infection in man. In: Transactions of the Royal Society of Tropical Medicine and Hygiene. 1964, Band 58, Nr. 4, S. 335–338, doi:10.1016/0035-9203(64)90201-9, PMID 14175744.
- ↑ K. C. Smithburn: Neutralizing antibodies against certain recently isolated viruses in the sera of human beings residing in East Africa. In: Journal of Immunology. Band 69, Nr. 2, 1952, S. 223–234, Zusammenfassung
- ↑ Alfonso J. Rodriguez-Morales: Zika: the new arbovirus threat for Latin America. In: Journal of infection in developing countries. Band 9, Nr. 6, 2015, S. 684–685, PMID 26142684, doi:10.3855/jidc.7230.
- ↑ Oumar Faye et al.: Molecular Evolution of Zika Virus during Its Emergence in the 20th Century. In: PLOS Neglected Tropical Diseases. Band 8, Nr. 1, 2012: e2636, doi:10.1371/journal.pntd.0002636.
- ↑ a b Martin Enserink: An obscure mosquito-borne disease goes global. In: Science. 2015, Band 350, Nr. 6264, S. 1012–1013, doi:10.1126/science.350.6264.1012.
- ↑ Edward B. Hayes: Zika virus outside Africa. In: Emerging Infectious Diseases. 2009, Band 15, Nr. 9, S. 1347–1350, PMID 19788800 (Volltext).
- ↑ Didier Musso, Albert I. Ko, David Baud: Zika Virus Infection – After the Pandemic. In: New England Journal of Medicine. 10. Oktober 2019, Band 281, Nr. 15, S. 1444–1457, doi:10.1056/NEJMra1808246.
- ↑ WHO: Zika virus disease – France. Abgerufen am 30. November 2019 (englisch).
- ↑ Zika virus: Fact sheet. WHO, Stand: Januar 2016; abgerufen am 1. Februar 2016.
- ↑ Gilda Grard, Mélanie Caron, Illich Manfred Mombo et al.: Zika Virus in Gabon (Central Africa) – 2007: A New Threat from Aedes albopictus? In: PLOS Neglected Tropical Diseases. 6. Februar 2014; doi:10.1371/journal.pntd.0002681 (englisch).
- ↑ Pei-Sze Jeslyn Wong, Mei-zhi Irene Li, Chee-Seng Chong et al.: Aedes (Stegomyia) albopictus (Skuse): A Potential Vector of Zika Virus in Singapore. In: PLOS Neglected Tropical Diseases. 1. August 2013; doi:10.1371/journal.pntd.0002348 (englisch).
- ↑ Zikavirus-Infektionen: Antworten auf häufig gestellte Fragen. Robert Koch-Institut, 29. Januar 2016
- ↑ a b A. Jansen, S. Luehken, R. Leggewie et al.: Experimental transmission of Zika virus by mosquitoes from central Europe. Hrsg.: University of Helsinki, Medicum Heitmann. European Centre for Disease Prevention and Control, 12. Januar 2017.
- ↑ Sébastien Boyer, Elodie Calvez, Thais Chouin-Carneiro, Diawo Diallo, Anna-Bella Failloux: An overview of mosquito vectors of Zika virus. In: Microbes and Infection (= Focus on Zika). Band 20, Nr. 11, 1. Dezember 2018, ISSN 1286-4579, S. 646–660, doi:10.1016/j.micinf.2018.01.006.
- ↑ Atchara Phumee, Jakkrawarn Chompoosri, Proawpilart Intayot, Rungfar Boonserm, Siwaporn Boonyasuppayakorn: Vertical transmission of Zika virus in Culex quinquefasciatus Say and Aedes aegypti (L.) mosquitoes. In: Scientific Reports. Band 9, Nr. 1, März 2019, ISSN 2045-2322, doi:10.1038/s41598-019-41727-8, PMID 30918310, PMC 6437171 (freier Volltext).
- ↑ Xiao-xia Guo, Chun-xiao Li, Yong-qiang Deng, Dan Xing, Qin-mei Liu: Culex pipiens quinquefasciatus: a potential vector to transmit Zika virus. In: Emerging Microbes & Infections. Band 5, Nr. 1, Januar 2016, ISSN 2222-1751, S. 1–5, doi:10.1038/emi.2016.102.
- ↑ Duschinka RD Guedes, Marcelo HS Paiva, Mariana MA Donato, Priscilla P Barbosa, Larissa Krokovsky: Zika virus replication in the mosquito Culex quinquefasciatus in Brazil. In: Emerging Microbes & Infections. Band 6, Nr. 1, Januar 2017, ISSN 2222-1751, S. 1–11, doi:10.1038/emi.2017.59.
- ↑ Fadila Amraoui, Célestine Atyame-Nten, Anubis Vega-Rúa, Ricardo Lourenço-de-Oliveira, Marie Vazeille: Culexmosquitoes are experimentally unable to transmit Zika virus. In: Eurosurveillance. Band 21, Nr. 35, 1. September 2016, ISSN 1025-496X, doi:10.2807/1560-7917.es.2016.21.35.30333.
- ↑ B. D. Foy, K. C. Kobylinski, J. L. C. et al. Foy: Probable Non–Vector-borne Transmission of Zika Virus, Colorado, USA. In: Emerging Infectious Diseases. Band 17. Jahrgang, Nr. 5, 2011, S. 880–2, doi:10.3201/eid1705.101939, PMID 21529401, PMC 3321795 (freier Volltext) – (englisch).
- ↑ Martin Enserink: Sex After a Field Trip Yields Scientific First. In: Science News. AAAS, 6. April 2011 (englisch).
- ↑ Dallas Co. Case Of Zika Virus Acquired Through Sexual Transmission. Auf: dfw.cbslocal.com vom 2. Februar 2016.
- ↑ DCHHS Reports First Zika Virus Case in Dallas County Acquired Through Sexual Transmission. Dallas County Health and Human Services (DCHHS), 2. Februar 2016; Volltext ( vom 3. Februar 2016 im Internet Archive) (PDF).
- ↑ Barry Atkinson et al.: Complete Genome Sequence of Zika Virus Isolated from Semen. In: Genome Announcements. Band 4, Nr. 5, e01116-16, 2016, doi:10.1128/genomeA.01116-16.
- ↑ Freddy A Medina et al.: Duration of the Presence of Infectious Zika Virus in Semen and Serum. In: The Journal of Infectious Diseases. Band 219, Nr. 1, 2019, S. 31–40, doi:10.1093/infdis/jiy462.
- ↑ Zika Virus: Clinical Evaluation & Disease. Auf: cdc.gov, Stand 19. Januar 2016.
- ↑ Virusausbruch in Südamerika: Drei Todesfälle von Zika-Patienten in Kolumbien gemeldet. Spiegel Online, 5. Februar 2016.
- ↑ Van-Mai Cao-Lormeau, Alexandre Blake, Sandrine Mons et al.: Guillain-Barré Syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study. In: The Lancet. Nr. 387, 2016, S. 1531, doi:10.1016/S0140-6736(16)00562-6.
- ↑ Zika-Virus-Infektion: Merkblatt für Beschäftigte und Reisende. (PDF) Hinweisblatt des Gesundheitsdienstes des deutschen Auswärtigen Amtes, Stand: 12/2015.
- ↑ Mysteriöses Virus: Brasilien ruft Gesundheitsnotstand aus. In: Spiegel Online. Abgerufen am 29. Januar 2016.
- ↑ Eric J. Rubi et al.: Zika Virus and Microcephaly. In: New England Journal of Medicine. Band 374, Nr. 10, 2016, S. 984–985, doi:10.1056/NEJMe1601862.
- ↑ Mysteriöses Zika-Virus: Die Angst vor dem zu kleinen Köpfchen. Spiegel Online, 17. Januar 2016.
- ↑ Zika Situation Report. (PDF; 614 kB) WHO, 12. Februar 2016.
- ↑ J. Mlakar et al.: Zika Virus Associated with Microcephaly. In: New England Journal of Medicine. 2016, PMID 26862926.
- ↑ A. S. Oliveira Melo et al.: Zika virus intrauterine infection causes fetal brain abnormality and microcephaly: tip of the iceberg? In: Ultrasound in Obstetrics & Gynecology. (UOG), 2016, Band 47, Nr. 1, S. 6–7; PMID 26731034 (englisch).
- ↑ CDC Concludes Zika Causes Microcephaly and Other Birth Defects. (Media Statement; 13. April 2016) cdc.gov; abgerufen am 22. April 2016.
- ↑ Brenda Goodman: CDC: Zika Virus Definitely Causes Microcephaly. Auf: medscape.com, 13. April 2016.
- ↑ Lyle R. Petersen, Denise J. Jamieson, Ann M. Powers, Margaret A. Honein: Zika Virus. In: New England Journal of Medicine. (NEJM), 21. April 2016, Band 374, S. 1552–1563, doi:10.1056/NEJMra1602113.
- ↑ Sonja A. Rasmussen, Denise J. Jamieson, Margaret A. Honein, Lyle R. Petersen: Zika Virus and Birth Defects – Reviewing the Evidence for Causality. In: New England Journal of Medicine. (NEJM), Special Report, 13. April 2016, doi:10.1056/NEJMsr1604338.
- ↑ Patrícia Brasil et al.: Zika Virus Infection in Pregnant Women in Rio de Janeiro. In: New England Journal of Medicine. Band 375, Nr. 24, 2016, S. 2321–2334, doi:10.1056/NEJMoa1602412
First hard look at Zika pregnancies finds nearly half result in miscarriage or birth defects. sciencemag.org, 13. Dezember 2016. - ↑ Celia Pedroso, Carlo Fischer, Marie Feldmann, Beate M. Kümmerer, Jan Felix Drexler et al.: Cross-protection of dengue virus infection against congenital Zika syndrome, northeast-ern Brazil. In: Emerging Infectious Diseases. August 2019.
- ↑ Anthony S. Fauci, David M. Morens: Zika Virus in the Americas – Yet Another Arbovirus Threat. In: New England Journal of Medicine. 13. Januar 2016, doi:10.1056/NEJMp1600297, PMID 26761185 (englisch).
- ↑ a b Factsheet about Zika virus disease. Auf: cdc.europa.eu; abgerufen am 26. März 2018.
- ↑ WPRO – Zika virus. In: wpro.who.int. Abgerufen am 6. Februar 2019 (englisch).
- ↑ Edward B. Hayes: Zika Virus Outside Africa. In: Emerging Infectious Diseases. Band 15. Jahrgang, Nr. 9, S. 1347–1350, doi:10.3201/eid1509.090442, PMID 19788800, PMC 2819875 (freier Volltext) – (englisch, cdc.gov).
- ↑ O. Faye, O. Faye, A. Dupressoir, M. Weidmann, M. Ndiaye, A. Alpha Sall: One-step RT-PCR for detection of Zika virus. In: J Clin Virol. 43. Jahrgang, Nr. 1, September 2008, S. 96–101, doi:10.1016/j.jcv.2008.05.005, PMID 18674965 (englisch, elsevier.com).
- ↑ R. S. Lanciotti, O. L. Kosoy, J. J. Laven et al.: Genetic and serologic properties of Zika virus associated with an epidemic, Yap State, Micronesia, 2007. In: Emerging Infectious Diseases. Band 14. Jahrgang, S. 1232–9, doi:10.3201/eid1408.080287 (englisch, cdc.gov).
- ↑ For Health Care Providers: Clinical Evaluation & Disease – Zika virus. In: cdc.gov. Abgerufen am 24. Dezember 2015 (englisch).
- ↑ N. Suttorp, M. Mielke, W. Kiehl, B. Stück: Infektionskrankheiten. Stuttgart 2004, ISBN 3-13-131691-8.
- ↑ Figure 3: Model of the ZIKV NS1 hexamer aus: Hao Song, Jianxun Qi, Joel Haywood, Yi Shi, George F Gao: Zika virus NS1 structure reveals diversity of electrostatic surfaces among flaviviruses. In: Nature Structural & Molecular Biology. Nr. 23, 2016, S. 456–458, doi:10.1038/nsmb.3213.
- ↑ Hohe Spezifität eines neuen Zikavirus-ELISA. In: Gesellschaft für Virologie Newsletter 4/2016. Auf: g-f-v.org; abgerufen am 27. Mai 2016.
- ↑ D. Huzly, I. Hanselmann, Jonas Schmidt-Chanasit|J. Schmidt-Chanasit, M. Panning: High specificity of a novel Zika virus ELISA in European patients after exposure to different flaviviruses. In: Eurosurveillance. 2016, Band 21, Nr. 16, 30203, doi:10.2807/1560-7917.ES.2016.21.16.30203.
- ↑ Jon Cohen: The race for a Zika vaccine is on. In: Science. 2016, Band 351, Nr. 6273, S. 543–544, doi:10.1126/science.351.6273.543.
- ↑ WHO vaccine pipeline tracker. WHO.
- ↑ Marton Széll: Zika-Virus – die neue, alte Gefahr. Einziger Schutz: Expositionsprophylaxe. Auf: gesundheitsnews.at, 8. Februar 2016.
- ↑ Fears that Zika causes brain damage in infants sparks vaccine hunt. Auf: sciencemag.org vom 2. Februar 2016.