El Vikipedio, la libera enciklopedio
Kalia germaniumato
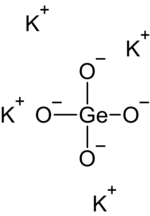
Plata kaj tridimensia kemiaj strukturoj de la Kalia meta-germaniumato
Plata kaj tridimensia kemiaj strukturoj de la Orto-kalia germaniumato
Alternativa(j) nomo(j)
Kemia formulo K2 GeO3
CAS-numero-kodo 12398-45-7
PubChem-kodo 13783482
Fizikaj proprecoj
Molmaso 198.824 g·mol−1
Sekurecaj Indikoj
Sekureco S36 S37 S38
Pridanĝeraj indikoj
Danĝero
GHS Damaĝo Piktogramo
GHS Signalvorto Averto
GHS Deklaroj pri damaĝoj H302 , H332 , H412
GHS Deklaroj pri antaŭgardoj P261 , P264 , P270 , P271 , P273 , P301+312 , P304+312 , P304+340 , P312 , P330 , P501
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo25 °C kaj 100 kPa)
Kalia germaniumato estas neorganika salo de kalio kaj germaniumata acido , blanka salo preparata per fando de germaniuma oksido kaj kalia oksido sub altaj temperaturoj. Ĝi estas trovebla sub du formoj: kalia meta-germaniumato (K2 GeO3 ) kaj kalia orto-germaniumato (K4 GeO4 ). La elementa germanio oksidiĝas malrapide al GeO2 ĉe 250 °C .
Ĝi estas nesolvebla en diluitaj acidoj kaj alkaloj sed dissolviĝas iom post iom en koncentrita sulfata acido kaj eksplode reakcias kun muelitaj alkaloj por produkti germaniumatojn (GeO3 2- . Germanio okazas ĉefe kiel oksidonombo +4 kvankam multaj komponaĵoj estas konataj kies oksidonombro estas +2. Kelkaj derivaĵoj de germanio estas uzataj kiel dietaj suplementoj.
Fando de germaniuma oksido kaj natria oksido:
G
e
O
2
+
K
2
O
→
T
K
2
G
e
O
3
{\displaystyle ~{\mathsf {GeO_{2}+K_{2}O\ {\xrightarrow {T}}\ K_{2}GeO_{3}}}}
G
e
O
2
+
K
2
C
O
3
→
1200
o
C
K
2
G
e
O
3
+
C
O
2
↑
{\displaystyle ~{\mathsf {GeO_{2}+K_{2}CO_{3}\ {\xrightarrow {1200^{o}C}}\ K_{2}GeO_{3}+CO_{2}\uparrow }}}
G
e
O
2
+
2
K
O
H
→
T
K
2
G
e
O
3
+
H
2
O
{\displaystyle ~{\mathsf {GeO_{2}+2\;KOH\ {\xrightarrow {T}}\ K_{2}GeO_{3}+H_{2}O}}}
G
e
+
2
H
2
O
2
+
2
K
O
H
→
K
2
G
e
O
3
+
3
H
2
O
{\displaystyle ~{\mathsf {Ge+2\;H_{2}O_{2}+2KOH\ {\xrightarrow {}}\ K_{2}GeO_{3}+3\;H_{2}O}}}
La anhidra kristala salo prepariĝas per heitado:
K
2
G
e
O
3
⋅
7
H
2
O
→
300
o
C
K
2
G
e
O
3
+
7
H
2
O
↑
{\displaystyle ~{\mathsf {K_{2}GeO_{3}\cdot 7H_{2}O\ {\xrightarrow {300^{o}C}}\ K_{2}GeO_{3}+7H_{2}O\uparrow }}}
La akvaj solvaĵoj estas alkalaj pro hidrolizo de la anjono:
G
e
O
3
2
−
+
H
2
O
⇄
H
G
e
O
3
−
+
O
H
−
{\displaystyle ~{\mathsf {GeO_{3}^{2-}+H_{2}O\ \rightleftarrows \ HGeO_{3}^{-}+OH^{-}}}}
K
2
G
e
O
3
+
6
H
C
l
→
K
2
[
G
e
C
l
6
]
+
3
H
2
O
{\displaystyle ~{\mathsf {K_{2}GeO_{3}+6\,HCl\ {\xrightarrow {}}\ K_{2}[GeCl_{6}]+3\,H_{2}O}}}
Ĝi malkomponiĝas per traktado kun diluitaj acidoj:
K
2
G
e
O
3
+
2
H
N
O
3
→
G
e
O
2
↓
+
2
K
N
O
3
+
H
2
O
{\displaystyle ~{\mathsf {K_{2}GeO_{3}+2\;HNO_{3}\ {\xrightarrow {}}\ GeO_{2}\downarrow +2\;KNO_{3}+H_{2}O}}}
K
2
G
e
O
3
+
3
H
2
O
→
O
H
−
K
2
[
G
e
(
O
H
)
6
]
{\displaystyle ~{\mathsf {K_{2}GeO_{3}+3\,H_{2}O\ {\xrightarrow {OH^{-}}}\ K_{2}[Ge(OH)_{6}]}}}
Germaniumato de kalio reakcias kun kvarhidroborato de kalio en akva solvaĵo por doni kvarhidreton de germanio kaj kalia metaborato :
K
2
G
e
O
3
+
K
B
H
4
k
v
a
r
h
i
d
r
o
b
o
r
a
t
o
d
e
k
a
l
i
o
+
H
2
O
→
T
G
e
H
4
+
2
K
O
H
+
K
B
O
2
m
e
t
a
b
o
r
a
t
o
d
e
k
a
l
i
o
{\displaystyle {K_{2}GeO_{3}+{\underset {kvarhidroborato\,de\,kalio}{KBH_{4}}}+H_{2}O{\xrightarrow[{}]{T}}GeH_{4}+2\,KOH+{\underset {metaborato\,de\,kalio}{KBO_{2}}}}}
Neorganikaj saloj de kalio