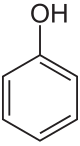
Fenol
| |||
| |||

| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
fenol
| |||
| Priporočeno IUPAC ime
Phenol[1] | |||
| Druga imena
karbolna kislina, karbol, benzenol, hidroksibenzen
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.003.303 | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| C6H6O | |||
| Molska masa | 94,11 g·mol−1 | ||
| Videz | prozorna kristalinična trdnina | ||
| Vonj | sladek, po katranu | ||
| Gostota | 1,07 g/mL (20 °C) | ||
| Tališče | 40,5 °C (104,9 °F; 313,6 K) | ||
| Vrelišče | 181,7 °C (359,1 °F; 454,8 K) | ||
| 8,3 g/L (20 °C) | |||
| Kislost (pKa) | 9,95 (v vodi), 29,1 (v acetonitrilu)[2] | ||
| Struktura | |||
| Dipolni moment | 1,224 D | ||
| Nevarnosti | |||
| GHS piktogrami | Predloga:GHSpPredloga:GHSpPredloga:GHSp[4] | ||
| 341, 331, 311, 301, 373, 314 | |||
| 280, 302+352, 301+330+331, 309, 310, 305+351+338[5] | |||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | 79 °C (174 °F; 352 K) | ||
| Sorodne snovi | |||
| Sorodne snovi | tiofenol natrijev fenoksid | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Fenol, karbolna kislina ali krajše karbol, je aromatska organska spojina s kemijsko formulo C6H5OH. Je bela kristalinična hlapna trdnina. Molekula je sestavljena iz fenilne skupine C6H5-, na katero je vezana hidroksilna skupina –OH. Fenol je srednje kisel in zahteva previdno rokovanje, ker povzroča kemične opekline.
Prvič so ga pridobili iz premogovega katrana, sedaj pa se industrijsko proizvaja iz nafte. Letna svetovna proizvodnja je približno 10 milijonov ton.[6] Od tega se je leta 2013 50 % fenola porabilo za proizvodnjo bisfenola A (surovina za plastične mase), 26 % za fenolne smole (bakelit), 12 % za kaprolaktam (surovina za poliamid 6), ostalih 12 % pa za druge proizvode.[7]
Fenoli so navidezno podobni alkoholom, vendar imajo povsem drugačne lastnosti. Za razliko od alkoholov, v katerih je –OH skupina vezana na nasičen ogljikov atom,[8] je pri fenolih vezana na nenasičen aromatski obroč, pri fenolu na benzenov.[9] Fenoli so zaradi stabilizacije konjugirane baze in resonance aromatskega obroča bolj kisli kot alkoholi.
Lastnosti
[uredi | uredi kodo]Fenol je zelo dobro topen v vodi (približno 84,2 g/L, 0,88 M). Poleg tega tvori homogene zmesi fenol-voda in voda-fenol do razmerja približno 1:2,6 ali celo več. Še bolj topna je njegova sol natrijev fenoksid (C6H5-ONa).
Kislost
[uredi | uredi kodo]Fenol je slabo kisel in pri visokih pH tvori fenolatni anion C6H5O-, ki se imenuje tudi fenoksid (Ph):[10]
- PhOH ⇌ PhO− + H+ (K = 10−10)
Fenol je milijonkrat bolj kisel od alifatskih alkoholov, a se kljub temu prišteva k šibkim kislinam. Popolnoma reagira z vodnim NaOH in porabi ves H+, medtem ko alkoholi reagirajo samo delno. Fenoli so manj kisli od karboksilnih kislin in celo ogljikove kisline.
Ena od razlag za povečano kislost v primerjavi z alkoholi je resonančna stabilizacija fenoksidnega aniona z aromatskim obročem. Negativni naboj kisika se na ta način delokalizira na orto in para ogljikova atoma.[11] Po drugi razlagi je povečana kislost posledica prekrivanja elektronskih orbital kisikovega prostega elektronskega para in aromatskega sistema.[12] Po tretji razlagi je posledica vpliva indukcije sp2 hibridiziranih ogljikovih atomov. pKa enola acetona je 10,9, kar je primerljivo s pKa fenola.[13] Kislosti fenola in enola acetona se v plinski fazi razlikujeta zaradi vpliva solvacije. Približno tretjina povečane kislosti fenola bi se lahko pripisalo indukcijskim učinkom, ostali dve tretjini razlike pa resonanci.[14]
Fenoksidni anion
[uredi | uredi kodo]
Fenoksidni anion ima podobno nukleofilnost kot prosti amini, vendar imajo to prednost, da se njihova konjugirana kislina (nevtralni fenol) celo v zmerno kislih pogojih ne deaktivira v celoti kot nukleofil. Fenoli se včasih uporabljajo v sintezi peptidov za aktiviranje karboksilnih kislin ali estrov, da se pretvorijo aktivirane estre. Fenolatni estri so bolj stabilni proti hidrolizi kot kislinski anhidridi in acil halidi, vendar so pod milimi pogoji dovolj reaktivni, da olajšajo tvorbo amidnih vezi.
Tavtomerija
[uredi | uredi kodo]
V fenolu je prisotna keto-enolna tavtomerija z nestabilnim keto tavtomerom cikloheksadienonom. Ravnotežna konstanta enolizacije je približno 10-13, se pravi da je v keto obliki vsak trenutek samo ena od deset trilijonov molekul.[15] Fenol je torej skoraj v celoti v enolni obliki.[16]
Fenoksidi so enolati, stabilizirani z aromatičnostjo. Pri normalnih pogojih so bolj reaktivni na položaju, kjer je kisikov atom, ki je "trd" nukleofil, medtem ko je α-ogljik "mehak".
Reakcije
[uredi | uredi kodo]
Fenol je zelo reaktiven v elektrofilnih aromatskih substitucijah, ker π elektroni kisikovega atoma donirajo svojo elektronsko gostoto aromatskemu obroču. Na obroč se zato lahko s halogeniranjem, acililiranjem, sulfoniranjem in drugimi postopki vežejo različne atomske skupine. Fenolni obroč je za nekatere reakcije tako močno aktiviran, bolj ativiran je samo anilin, da med bromiranjem in kloriranjem substitucija ne poteče samo na enem ogljikovem atomu, ampak na obeh orto in para ogljikovem atomu.
Vodne raztopine fenola so rahlo kisle in moder lakmusov papir obarvajo rahlo rdeče. Fenol se zlahka nevtralizira z natijevim hidroksidom, pri čemer nastane natrijev fenolat (ali fenat). Je šibkejša kislina kot ogljikova kislina, zato se ne more nevtralizirati z natrijevim bikarbonatom ali natrijevim karbonatom, da bi se sprostil ogljikov dioksid.
- C6H5OH + NaOH → C6H5ONa + H2O
Če se zmes fenola in benzoil klorida stresata v prisotnosti razredčene raztopine natrijevega hidroksida, nastane fenil benzoat (primer Schotten-Baumannove reakcije):
- C6H5OH + C6H5COCl → C6H5OCOC6H5 + HCl
Če se fenol destilira s cinkovim prahom ači če njegove pare prehajajo skozi granuliran cink pri 400 °C, se reducira v benzen:[17]
- C6H5OH + Zn → C6H6 + ZnO
Če fenol reagira z diazometanom v prisotnosti borovega trifluiroda (BF3), kot glavna produkta nastaneta anisol in plinasti dušik:
- C6H5OH + CH2N2 → C6H5OCH3 + N2
Proizvodnja
[uredi | uredi kodo]Fenol se lahko proizvaja po več postopkih. Trenutno prevladuje postopek delne oksidacije kumena (izopropilbenzena) s Hockovo premestitvijo, po katerem se proizvede približno 95 % fenola (2003):[18]
- C6H5CH(CH3)2 + O2 → C6H5OH + (CH3)2CO
Kumensko-peroksidni postopek zahteva v primerjavi z večino drugih procesov relativno mile reakcijske pogoje in relativno poceni surovine, vendar njegova gospodarnost ni odvosna samo od prodaje fenola, ampak tudi od prodaje stranskega proizvoda acetona.
Eden od prvih postokov, ki sta ga razvila Bayer in Monsanto na začetku 20. stoletja, se je začel z reakcijo močne baze z benzensulfonatom: [19]
- C6H5SO3H + 2 NaOH → C6H5OH + Na2SO3 + H2O
Med druge postopkeza proizvodnjo fenola spadajo:
- hidroliza klorobenzena z bazo ali vodno paro (Raschig–Hookerjev postopek):[20]
- C6H5Cl + H2O → C6H5OH + HCl
- oksidacija benzena z didušikovim oksidom, ki je potencialno"zelen" postopek:
- C6H6 + N2O → C6H5OH + N2
- oksidacija toluena, ki jo je razvil Dow Chemical:
- C6H5CH3 + 2 O2 → C6H5OH + CO2 + H2O
Uporaba
[uredi | uredi kodo]Približno dve tretjini fenola se porabi za proizvodnjo plastičnih mas ali surovin zanje. S kondenzacijo fenola z acetonom nastane bisfenol A, ki je ključna surovina za proizvodnjo polikarbonatov in epoksidnih smol. S polikondenzacijo fenola, alkilfenolov ali difenolov s formaldehidom nastanejo fenolne smole, od katerih je najbolj znan bakelit. Z delnim hidrogeniranjem nastane cikloheksanon, ki je osnova za sintezo najlona. Neionski detergenti se proizvajajo z alkilacijo fenola, s katero nastanejo alkilfenoli, na primer nanolfenol, ki se zatem etoksilirajo.[18]
Fenol je osnovna surovina tudi za številna zdravila, od katerih je najbolj znan aspirin, in herbicidov.
Drugo
[uredi | uredi kodo]Fenol se je nekoč uporabljal kot antiseptik, predvsem v karbolnih milih, ki so se na široko uporabljala od začetka 20. stoletja do 1970. let. Je tudi ena od komponent v sredstvih za odstranjevanje barvnih premazov, ki se v letalski industriji uporabljajo za odstranjevanje predvsem epoksidnih, poliuretanskih in drugih kemično odpornih premazov.[21] Derivati fenola se uporabljajo tudi za pripravo kozmetičnih preparatov, na primer sredstev za zaščito pred soncem[22] barvanje las in svetlenja kože.[23]
Koncentrirane raztopine fenola se pogosto uporabljajo za kirurško obdelavo vraščenih nohtov na nogah, ker preprečujejo ponovno vraščanje odrezanega dela nohta. Postopek se imenuje fenolizacija.
Zgodovina
[uredi | uredi kodo]Nečist fenol je leta 1834 izoliral Friedlieb Ferdinand Runge iz premogovega katrana.[24] Runge ga je imenoval karbolna kislina (Karbolsäure). Premogov katran je bil glavni vir fenola vse do razvoja petrokemijske industrije. Čist fenol je leta 1841 izoliral francoski kemik Auguste Laurent.[25]
Leta 1836 si je Auguste Laurent za benzen izmislil ime "phène"[26] (iz grškega φαινω [faino], iluminat), ker ga je odkril v svetilnem plinu. Ime je postalo koren za besedi fenol in fenil. Leta 1843 je francoski kemik Charles Gerhardt phène preimenoval v fenol.[27]
Antiseptične lastnosti fenola je odkril in izkoriščal kirurg Joseph Lister (1827–1912) v svojih pionirskih antiseptičnih operacijah. Lister je zahteval, da se rane popolnoma očistijo, in nato prekrijejo s kosom tkanine ali vato, namočeno v fenol.[28] Stalna izpostavljenost fenolu je dražila kožo, kar je nazadnje privedlo do zamenjave fenola z manj agresivnimi razkužili.
Fenol je aktivna komponenta nekaterih oralnih analgetikov.
Fenol je bil tudi glavna sestavina tako imenovane "karbolne dimne žoge", neučinkovite naprave, ki so jo v 19. stoletju tržili v Londonu in naj bi ščitila pred gripo in drugim boleznim. Njena raba se je končala z razvpitim sodnim procesom.
Druga svetovna vojna
[uredi | uredi kodo]Toksičen vpliv fenola na osrednje živčevje povzroči takojšnjo izgubo zavesti pri ljudeh in živalih. Temu sledijo krči, ki so posledica nekontrolirane aktivnosti osrednjega živčevja.[29] Leta 1939 so začeli nacisti v okviru Akcije T4 uporabljati injekcije fenola za usmrčevanje posameznikov.[30] Za usmrčevanje manjših skupin so jih uporabljali tudi potem, ko so za množične pomore začeli uporabljati Zyklon-B,[31] zlasti v taborišču Auschwitz-Birkenau. Za usmrtitev človeka zadostuje 1 g fenola.[32][33] Najbolj znan zapornik, ki je bil v Auschwitzu umorjen s fenolom, je bil poljski katoliški duhovnik Maksimilijan Kolbe, ki je šel prostovoljno v smrt namesto nekega njemu neznanega zapornika.[33]
Naravna nahajališča
[uredi | uredi kodo]Fenol je normalen človekov presnovni produkt, ki se izloča z urinom v količinah do 40 mg / L.[29]
Izloček senčnih žlez slonjih samcev med mastom vsebujejo nekaj fenola in 4-metilfenola. [34][35]
Fenol je tudi ena od spojin, ki jih vsebuje bobrovina. Bobrovino se nabira z rastlin, s katerimi se bober prehranjuje.[36]
Viski
[uredi | uredi kodo]Fenol je merljiva komponenta arome in okusa islayskega škotskega viskija.[37] Običajne vsebnosti so približno 30 ppm, dosežejo pa tudi vrednosti preko 150 ppm. Fenol nastaja med praženjem ječmena v slad.[38]
Biološka razgradnja
[uredi | uredi kodo]Bakterija Cryptanaerobacter phenolicus presnavlja fenol in ga preko 4-hidroksibenzoata pretvarja v benzoat.[39] Bakterija Rhodococcus phenolicus lahko razgrajuje fenol kot edini vir ogljika.[40]
Toksičnost
[uredi | uredi kodo]Fenol in njegovi hlapi razjedajo oči, kožo in dihalne poti.[41] Razjedanje kože in sluzničnih membran je posledica njegovega degenerativnega učinka na beljakovine.[29] Ponavljajoč ali dolgotrajen stik s kožo lahko povzroči fenolni dermatitis in opekline druge ali celo tretje stopnje.[42] Vdihavanje fenolnih hlapov lahko povzroči pljučni edem.[41] Fenol ima škodljive učinke na osrednje živčevje in srce, ki se lahko končajo z aritmijo, srčnim napadom in komo.[43] Dolgotrajna ali ponavljajoča se izpostavljenost ima lahko škodljive učinke tudi na jetra in ledvice.[44] Njegova rakotvornost na ljudeh ni dokazana.[45] Eden od vzrokov za njegovo toksičnost bi poleg hidrofobnosti lahko bilo tudi nastajanje prostih fenoksilnih radikalov.[46]
Ker se fenol relativno hitro resorbira skozi kožo, lahko poleg lokalnih opeklin povzroči tudi splošno zastrupitev organizma.[29] Velike količine fenola se lahko resorbirajo tudi skozi majhno površino kože. Zastrupitvi hitro sledi paraliza osrednjega živčevja in resen padec telesne temperature. Oralna toksičnost LD50 za pse, kunce in miši je 300-500 mg/kg telesne mase. Smrtni odmerek za človeka je 140 mg/kg telesne mase.[29]
Kemične opekline se lahko dekontaminirajo s spiranjem polietilen glikolom,[47] izopropil alkoholom[48] in morda celo z zelo velikimi količinami vode.[49] Kontaminirana oblačila se mora sleči in takoj poiskati zdravniško pomoč. To je zlasti pomembno, če je fenol pomešan s kloroformom. Takšna zmes se uporablja v molekularni biologiji za očiščevanje DNA in RNA. Fenol je tudi reprodukcijski toksin, ki poveča verjetnost splava in majhne porodne mase.
Sklici
[uredi | uredi kodo]- ↑ »Front Matter«. Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. str. 690. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Only one name is retained, phenol, for C6H5-OH, both as a preferred name and for general nomenclature.
- ↑ A. Kütt, V. Movchun, T. Rodima, T. Dansauer, E.B. Rusanov, I. Leito, I. Kaljurand, J. Koppel, V. Pihl, I. Koppel, G. Ovsjannikov, L. Toom, M. Mishima, M. Medebielle, E. Lork, G.V. Röschenthaler, I.A. Koppel, A.A. Kolomeitsev (2008). Pentakis(trifluoromethyl)phenyl, a Sterically Crowded and Electron-withdrawing Group: Synthesis and Acidity of Pentakis(trifluoromethyl)benzene, -toluene, -phenol, and -aniline. The Journal of Organic Chemistry 73 (7): 2607–20. doi: 10.1021/jo702513w. PMID 18324831.
- ↑ http://omlc.ogi.edu/spectra/PhotochemCAD/html/phenol.html
- ↑ Sigma-Aldrich Co., Phenol. Pridobljeno 2013-07-20.
- ↑ GESTIS-Stoffdatenbank Arhivirano 2015-04-05 na Wayback Machine..
- ↑ The Essential Chemical Industry online. Pridobljeno 1. januarja 2015.
- ↑ Phenol: 2014 World Market Outlook and Forecast up to 2018. Pridobljeno 1. januarja 2015.
- ↑ Alcohols. IUPAC, Compendium of Chemical Terminology. 2. izdaja. 1997.
- ↑ Phenols. IUPAC, Compendium of Chemical Terminology. 2. izdaja. 1997.
- ↑ M.B. Smith, J. March (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. 6. izdaja. New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ↑ Organic Chemistry. 2. Izdaja. John McMurry, ISBN 0-534-07968-7.
- ↑ J. Clark. The Acidity of Phenol. ChemGuide. Jim Clark. Pridobljeno 5. avgusta 2007.
- ↑ Acidity Concepts of Organic Molecules.
- ↑ P.J. Silva (2009). Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens. J. Org. Chem. 74 (2): 914–916. doi: 10.1021/jo8018736. PMID 19053615.
- ↑ M. Capponi, I.G. Gut, B. Hellrung, G. Persy, J. Wirz (1999). Ketonization equilibria of phenol in aqueous solution. Can. J. Chem. 77 (5–6): 605–613. doi: 10.1139/cjc-77-5-6-605.
- ↑ J. Clayden, N. Greeves, S. Warren, P. Wothers (2001). Organic Chemistry. 1. Izdaja. Oxford University Press. Str. 531. ISBN 978-0-19-850346-0.
- ↑ H. Roscoe (1891). A treatise on chemistry 3, 3. London: Macmillan & Co. Str. 23.
- ↑ 18,0 18,1 Manfred Weber, Markus Weber, M. Kleine-Boymann (2004). Ullmann's Encyclopedia of Industrial chemistry. doi:10.1002/14356007.a19_299.pub2. ISBN 3527306730.
- ↑ H.A. Wittcoff, B.G. Reuben (1980). Industrial Organic Chemicals in Perspective. Part One: Raw Materials and Manufacture. Wiley-Interscience, New York.
- ↑ 20,0 20,1 H.-G. Franck, J.W. Stadelhofer (1988). Industrial Aromatic Chemistry. Springer-Verlag, New York. Str. 148-155.
- ↑ CH207 Aircraft paintstripper, phenolic, acid. Callington. 14. october 2009. Pridobljeno 27. avgusta 2011.
- ↑ A. Svobodová, J. Psotová, D. Walterová (2003). Natural Phenolics in the Prevention of UV-Induced Skin Damage. A Review. Biomed. Papers 147 (2): 137–145. doi: 10.5507/bp.2003.019.
- ↑ R. H. DeSelms. UV-Active Phenol Ester C ompounds. Enigen Science Publishing. Washington, DC, 2008.
- ↑ F. F. Runge (1834). Über einige Produkte der Steinkohlendestillation. Annalen der Physik und Chemie, 31: 65-78 in 308-328.
- ↑ A. Laurent (1841). Mémoire sur le phényle et ses dérivés. Annales de Chimie et de Physique 3 (3): 195-228.
- ↑ A. Laurent (1836). Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique. Annales de Chemie et de Physique 63: 27–45.
- ↑ C. Gerhardt (1843). Recherches sur la salicine. Annales de Chimie et de Physique 3 (7): 215-229.
- ↑ J. Lister (1867). Antiseptic Principle Of The Practice Of Surgery. Modern History Sourcebook.
- ↑ 29,0 29,1 29,2 29,3 29,4 Phenol. Ullmann's Encyclopedia of Industrial Chemistry 25: 589–604. Wiley-VCH. 2003.
- ↑ R.J. Lifton. The Nazi Doctors Arhivirano 2017-10-22 na Wayback Machine.. 14. poglavje. Killing with Syringes: Phenol Injections.
- ↑ P. Tyson. The Experiments. NOVA.
- ↑ Phenol: Hazards and Precautions Arhivirano 2012-04-05 na Wayback Machine.. University of Connecticut, USA. Pridobljeno 2. decembra 2011.
- ↑ 33,0 33,1 Killing through phenol injection. Auschwitz: Final Station Extermination. Linz, Austria: Johannes Kepler University. Pridobljeno 29. septembra 2006.
- ↑ L.E.L Rasmussen, T.E. Perrin (1999). Physiological Correlates of Musth. Physiology & Behavior 67 (4): 539. doi: 10.1016/S0031-9384(99)00114-6.
- ↑ D. Ananth. Musth in elephants. Zoo's print journal 15 (5): 259-262.
- ↑ D. Müller-Schwarze (2003). The Beaver: Its Life and Impact. Str. 43.
- ↑ P. Brossard. Peat, Phenol and PPM. Pridobljeno 27. maja. 2008.
- ↑ Bruichladdich Octomore 4.2 "Comus" Islay Single Malt Whisky Arhivirano 2016-04-21 na Wayback Machine..
- ↑ P. Juteau, V. Côté, M.F. Duckett, R. Beaudet, F. Lépine, R. Villemur, J.G. Bisaillon (2005). Cryptanaerobacter phenolicus gen. nov., sp. nov., an anaerobe that transforms phenol into benzoate via 4-hydroxybenzoate. International Journal of Systematic and Evolutionary Microbiology 55 (1): 245–50. doi: 10.1099/ijs.0.02914-0. PMID 15653882.
- ↑ M. Rehfuss, J. Urban (2005). Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources. Systematic and Applied Microbiology 28 (8): 695–701. doi: 10.1016/j.syapm.2005.05.011. PMID 16261859.
- ↑ 41,0 41,1 S. Budavari, urednik (1996). The Merck Index: An Encyclopedia of Chemical, Drugs, and Biologicals. Whitehouse Station, NJ: Merck.
- ↑ T.M. Lin, S.S. Lee, C.S. Lai, S.D. Lin (junij 2006). Phenol burn. Burns: Journal of the International Society for Burn Injuries 32(4): 517–21. doi: 10.1016/j.burns.2005.12.016. PMID 16621299.
- ↑ M.A. Warner, J.V. Harper (1985). Cardiac dysrhythmias associated with chemical peeling with phenol. Anesthesiology 62 (3): 366–7. doi: 10.1097/00000542-198503000-00030. PMID 2579602.
- ↑ World Health Organization/International Labour Organization: International Chemical Safety Cards.
- ↑ How can phenol affect my health?. U.S. Department of Health and Human Services. Toxicological Profile for Phenol: 24.
- ↑ C. Hanscha, S.C. McKarns, C.J. Smith, D.J. Doolittle (junij 2000). Comparative QSAR evidence for a free-radical mechanism of phenol-induced toxicity. Chemico-Biological Interactions 127 (1): 61–72. doi: 10.1016/S0009-2797(00)00171-X. PMID 10903419.
- ↑ V.K.H. Brown, V.L. Box, B.J. Simpson (1975). Decontamination procedures for skin exposed to phenolic substances. Archives of Environmental Health 30 (1): 1–6. doi: 10.1080/00039896.1975.10666623. PMID 1109265.
- ↑ D.M. Hunter, B.L. Timerding, R.B. Leonard, T.H. McCalmont, E. Schwartz (1992). Effects of isopropyl alcohol, ethanol, and polyethylene glycol/industrial methylated spirits in the treatment of acute phenol burns. Annals of Emergency Medicine 21 (11): 1303–7. doi: 10.1016/S0196-0644(05)81891-8.
- ↑ T.G. Pullin, M.N. Pinkerton, R.V. Johnston, D.J. Kilian (1978). Decontamination of the skin of swine following phenol exposure: a comparison of the relative efficacy of water versus polyethylene glycol/industrial methylated spirits. Toxicol Appl Pharmacol 43 (1): 199–206. doi: 10.1016/S0041-008X(78)80044-1. PMID 625760.