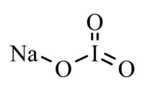
Sodyum iyodat
Görünüm
| |
Diğer adlar İyodik asitin sodyum tuzu | |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.028.793 |
| EC Numarası |
|
PubChem CID
|
|
| RTECS numarası |
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Kimyasal formül | INaO3 |
| Molekül kütlesi | 197,89 g mol−1 |
| Görünüm | Beyaz ortorombik kristaller |
| Koku | Kokusuz |
| Yoğunluk | 4.28 gr/cm3 |
| Erime noktası | 425 °C (susuz) parçalanır[3] |
| Çözünürlük (su içinde) | 2.5 gr/100 mL (0 °C) 8.98 gr/100 mL (20 °C) 9.47 gr/100 mL (25 °C)[1] 32.59 gr/100 mL (100 °C)[2] |
| Çözünürlük | asetik asitte çözünür alkolde çözünmez |
| Çözünürlük (dimetilformamid içinde) | 0.5 gr/kg[1] |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar |    [4] [4]
|
| İşaret sözcüğü | Danger |
| Tehlike ifadeleri | H272, H302, H317, H334[4] |
| Önlem ifadeleri | P220, P261, P280, P342+P311[4] |
| NFPA 704 (yangın karosu) |
|
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
108 mg/kg (fare, damar içi)[1] |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Sodyum iyodat, (NaIO3) iyodik asitin sodyum tuzudur. Sodyum iyodat oksitleyici madde olduğundan, yanıcı maddeler ya da indirgeyici maddelerle temas ettiğinde alev almalarına sebep olabilir.
Hazırlama
[değiştir | kaynağı değiştir]Sodyum iyodat,sodyum hidroksitin iyodik asitle reaksiyona girmesi ile hazırlanabilir:
Ayrıca, iyotun sıcak ve derişik sodyum hidroksit ya da sodyum karbonat çözeltisine etkimesi ile de hazırlanabilir:
Reaksiyonları
[değiştir | kaynağı değiştir]Sodyum iyodat sulu çözeltilerinde hipokloritler ya da diğer kuvvetli oksitleyici maddelerle sodium periyodata yükseltgenebilir:
Güvenlik
[değiştir | kaynağı değiştir]Sodyum iyodat, ısı, şok, sürtünme kuvveti gibi şartlarla; yanıcı maddeler, indirgeyici maddeler, alüminyum, organik bileşikler, karbon, hidrojen peroksit ve kükürt gibi maddelere maruz bırakılmamalıdır.
Yararlanılan kaynaklar
[değiştir | kaynağı değiştir]- ^ a b c "Arşivlenmiş kopya". 25 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Kasım 2014.
- ^ {{Kitap kaynağı|soyadı = Seidell|ad = Atherton|soyadı2 = Linke|ad2 = William F.|yıl = 1919|başlık = Solubilities of Inorganic and Organic Compounds|url = https://archive.org/details/solubilitiesino01seidgoog%7Cyayıncı = D. Van Nostrand Company|basım=2.2
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87 bas.). Boca Raton, FL: CRC Press. ss. 4-85. ISBN 0-8493-0594-2.
- ^ a b c Sigma-Aldrich Co., Sodium iodate. Retrieved on 25 Mayıs 2014.
