Ацетилен
| |

| |
Назив според МСЧПХ | |
| Назнаки | |
|---|---|
| 74-86-2 | |
| 3Д-модел (Jmol) | Слика |
| |
| ОН-бр. | 1001 (растворен) 3138 (во смеса со етилен and пропилен) |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Густина | 1,097 кг/м3 |
| Точка на топење | |
| Точка на вриење | |
| Киселост (pKa) | 25 |
| Термохемија | |
| Ст. енталпија на образување ΔfH |
+226,88 kJ/mol |
| Опасност | |
| NFPA 704 | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Ацетилен (систематско име: етин) — органско соединение со хемиска формула HC2H и структура H−C≡C−H. Ацетиленот е јаглеводород и претставува наједноставниот алкин.[1] Овој безбоен гас е широко користен како гориво и хемиска градбена материја. Тој е нестабилен во својот чист облик и затоа обично се третира како раствор.[2] Чистиот ацетилен е без мирис, но комерцијалните сорти обично имаат изразен мирис поради нечистотии како што се дивинил сулфид и фосфин.[2][3]
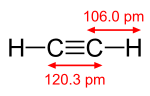
Како алкин, ацетиленот е незаситени бидејќи неговите два јаглеродни атоми се сврзани заедно во тројна врска. Тројната врска јаглерод-јаглерод ги поставува сите четири атоми во иста права линија, со агли на врската CCH од 180°.[4]
Физички својства
[уреди | уреди извор]Промена на состојба
[уреди | уреди извор]На атмосферски притисок, ацетиленот не може да постои како течност и нема точка на топење. тројната точка на фазен дијаграм одговара на точката на топење (−80,8 °C) при минималниот притисок при кој може да постои течен ацетилен (1,27 атм). На температури под тројната точка, цврстиот ацетилен може директно да се промени во пареа (гас) со сублимација. Точката на сублимација при атмосферски притисок е -84,0 °C.[5]
Друго
[уреди | уреди извор]На собна температура, растворливоста на ацетилен во ацетон е 27,9 г на кг. За иста количина на диметилформамид, растворливоста е 51 г. На 20,26 бари, растворливоста се зголемува на 689,0 и 628,0 г за ацетон и диметилформамид, редоследно. Овие растворувачи се користени во гасни цилиндри под притисок.[6]
Реакции
[уреди | уреди извор]Винилациски реакции
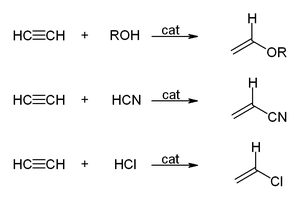
[уреди | уреди извор]Во реакциите на винилација, соединенијата на H−X се додадени низ тројната врска. Алкохоли и феноли се додавани во ацетилен за да се добие винил етер. Тиолите даваат винил тиоетери. Слично, винилпиролидон и винилкарбазол се произведувани индустриски со винилација на 2-пиролидон и карбазол.[2][6]
Хидратацијата на ацетиленот е реакција на винилација, но добиениот винил алкохол се изомеризира во ацеталдехид. Реакцијата се катализира со соли на жива. Оваа реакција некогаш била најзастапена технологија за производство на ацеталдехид, но таа била поместена од Вакеровата постапка, кој дава ацеталдехид со оксидација на етилен, поевтина суровина. Слична ситуација се однесува на претворањето на ацетилен во вредниот винил хлорид со хидрохлорирање наспроти оксихлорирање на етилен.
Винил ацетат е користен наместо ацетилен за некои винилации, кои попрецизно се опишани како трансвинилации.[7] Во синтезата на винил формат се користени повисоки естри на винил ацетат.
Етинилација
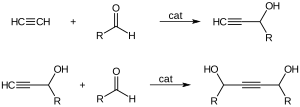
[уреди | уреди извор]Ацетиленот додава во алдехиди и кетони за да образува α-етинил алкохоли:[2]
Реакцијата со формалдехид е користена индустриски во производството на бутинедиол, правејќи пропаргил алкохол како нуспроизвод. Бакар ацетилид е користен како катализатор.[8][9]
Бидејќи халогените се додаваат низ тројната врска, заменетите ацетилени дифлуороацетилен, дихлороацетилен, дибромоацетилен и дијодоацетилен не можат да бидат направени директно од ацетилен. Вообичаено решение е да бидат дехидрирани винил дихалоетенолите.[10]
Карбонилација
[уреди | уреди извор]Валтер Репе открил дека во присуство на катализатори, ацетиленот реагира и дава широк опсег на индустриски значајни хемикалии.[2][11][12]
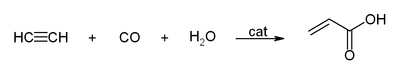
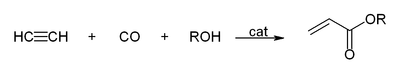
Со јаглерод моноксид, ацетиленот реагира и дава акрилна киселина, или акрилни естри, кои може да бидат користени за производство на акрилно стакло.[13]
Органометалска хемиска
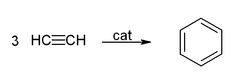
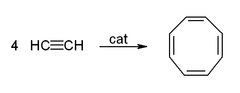
[уреди | уреди извор]Ацетиленот и неговите деривати (2-бутин, дифенилацетилен, итн.) образуваат комплекси со преодни метали. Неговата врска со металот е нешто слична на онаа на етиленските комплекси. Овие комплекси се посредници во многу каталитички реакции како што се алкинска тримеризација кон бензен, тетрамеризација кон циклооктатетраен,[2] и карбонилација во хидрохинон:[11]
- во основни услови (50–80 degC, 20–25 atm).
Во присуство на одредени преодни метали, алкините се подложени на алкинска метатеза.
Чести се и метални ацетилид, видови со формулата L
nM–C
2R. Бакар(I) ацетилид и сребро ацетилид може лесно да бидат создадени во водени раствори поради лошата рамнотежа на растворливост.[14]
Киселинско-базни реакции
[уреди | уреди извор]Ацетиленот има pKa од 25, ацетиленот може да биде депротониран со супербаза за да образува ацетилид:[14]
Различни органометални[15] и неорганско[16] реагенси се ефикасни.
Наводи
[уреди | уреди извор]- ↑ R. H. Petrucci; W. S. Harwood; F. G. Herring (2002). General Chemistry (8. изд.). Prentice-Hall. стр. 1072.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Pässler, Peter; Hefner, Werner; Buckl, Klaus; Meinass, Helmut; Meiswinkel, Andreas; Wernicke, Hans-Jürgen; Ebersberg, Günter; Müller, Richard; Bässler (2008), „Acetylene Chemistry“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_097.pub3
- ↑ Compressed Gas Association (1995) Material Safety and Data Sheet – Acetylene Архивирано на 11 јули2012.
- ↑ Whitten K. W., Gailey K. D. and Davis R. E. General Chemistry (4. изд., Saunders College Publishing 1992), стр. 328–329, 1046. ISBN 0-03-072373-6.
- ↑ Handbook of Chemistry and Physics (60th ed., CRC Press 1979–80), p. C-303 in Table Physical Constants of Organic Compounds (listed as ethyne).
- ↑ 6,0 6,1 Harreus, Albrecht Ludwig; Backes, R.; Eichler, J.-O.; Feuerhake, R.; Jäkel, C.; Mahn, U.; Pinkos, R.; Vogelsang"2-Pyrrolidone, R. (2011), Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_457.pub2
- ↑ Manchand, Percy S. (2001). „Vinyl Acetate“. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rv008. ISBN 0471936235.
- ↑ Gräfje, Heinz; Körnig, Wolfgang; Weitz, Hans-Martin; Reiß, Wolfgang; Steffan, Guido; Diehl, Herbert; Bosche, Horst; Schneider, Kurt; Kieczka, Heinz (15 јуни 2000), „Butanediols, Butenediol, and Butynediol“, Во Wiley-VCH Verlag GmbH & Co. KGaA (уред.), Ullmann's Encyclopedia of Industrial Chemistry (англиски), Вајнхајм, Германија: Wiley-VCH Verlag GmbH & Co. KGaA, стр. a04_455, doi:10.1002/14356007.a04_455, ISBN 978-3-527-30673-2, S2CID 178601434, Архивирано од изворникот 19 март 2022, Посетено на 23 февруари 2023
- ↑ Falbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter (15 јуни 2000), „Alcohols, Aliphatic“, Во Wiley-VCH Verlag GmbH & Co. KGaA (уред.), Ullmann's Encyclopedia of Industrial Chemistry (англиски), Вајнхајм, Германија: Wiley-VCH Verlag GmbH & Co. KGaA, стр. a01_279, doi:10.1002/14356007.a01_279, ISBN 978-3-527-30673-2, Архивирано од изворникот 9 март 2022, Посетено на 23 февруари 2023
- ↑ Kloster-Jenson, Else (1971). „Preparation and physical characterization of pure hetero and homo dihaloacetylenes“. Tetrahedron. 27 (1): 33–49. doi:10.1016/S0040-4020(01)92395-6.
- ↑ 11,0 11,1 Reppe, Walter; Kutepow, N; Magin, A (1969). „Cyclization of Acetylenic Compounds“. Angewandte Chemie International Edition in English. 8 (10): 727–733. doi:10.1002/anie.196907271.
- ↑ Trotuş, Ioan-Teodor; Zimmermann, Tobias; Schüth, Ferdi (14 ноември 2013). „Catalytic Reactions of Acetylene: A Feedstock for the Chemical Industry Revisited“. Chemical Reviews. 114 (3): 1761–1782. doi:10.1021/cr400357r. PMID 24228942.
- ↑ Takashi Ohara; Takahisa Sato; Noboru Shimizu; Günter Prescher; Helmut Schwind; Otto Weiberg; Klaus Marten; Helmut Greim (2003). „Acrylic Acid and Derivatives“. Ullmann's Encyclopedia of Industrial Chemistry: 7. doi:10.1002/14356007.a01_161.pub2. ISBN 3527306730.
- ↑ 14,0 14,1 Viehe, Heinz Günter (1969). Chemistry of Acetylenes (1. изд.). Њујорк: Marcel Dekker, inc. стр. 170–179 & 225–241. ISBN 978-0824716752.
- ↑ Midland, M. M.; McLoughlin, J. I.; Werley, Ralph T. (Jr.) (1990). „Preparation and Use of Lithium Acetylide: 1-Methyl-2-ethynyl-endo-3,3-dimethyl-2-norbornanol“. Organic Syntheses. 68: 14. doi:10.15227/orgsyn.068.0014.
- ↑ Coffman, Donald D. (1940). „Dimethylethhynylcarbinol“. Organic Syntheses. 40: 20. doi:10.15227/orgsyn.020.0040.
Надворешни врски
[уреди | уреди извор]| „Ацетилен“ на Ризницата ? |
- Фабрика за производство на ацетилен и подробна постапка Архивирано на 11 април 2015.
- Ацетилен на Chemistry Comes Alive!
- Acetylene, the Principles of Its Generation and Use на Проектот „Гутенберг“
- Филм што го објаснува создавањето на ацетилен од калциум карбид и границите на експлозив што прават опасност од пожар
- Калциум карбид и ацетилен на Periodic Videos (Универзитет во Нотингем)
- Џебен водич за хемиски опасности - ацетилен
|